导读: 依据是否具有在熔融态或水溶液中导电的能力,可以将化合物分为电解质和非电解质。中国招生考试网www chinazhaokao com 小编为大家整理 ...
水的电离和溶液的酸碱性
《水的电离和溶液的酸碱性》课时练
双基练习
1.(2011•新课标全国高考)将浓度为0.1 mol/LHF溶液加水不断稀释,下列各量始终保持增大的是( )
A.c(H+) B.Ka(HF)
C.cF-cH+ D.cH+cHF
解析:HF属于弱电解质,加水促进HF的电离平衡向右移动,即电离程度增大,但电离平衡常数只与温度有关,所以选项B不变;但同时溶液的体积也增大,所以溶液的酸性会降低,即c(H+)、c(F-)和c(HF)的浓度均降低,考虑到溶液中水还会电离出氢离子,所以稀释到一定程度(即无限稀释时),c(H+)就不再发生变化,但c(F-)和c(HF)却一直会降低,所以选D符合题意。
答案:D
2.(2011•咸阳高二检测)常温下,c(OH-)最小的是( )
A.pH=0的溶液
B.0.05 mol/L H2SO4
C.0.5 mol/L HCl
D.0.05 mol/L的Ba(OH)2
解析:四种溶液中OH-的浓度分别为1×10-14 mol/L、1×10-13 mol/L、2×10-14 mol/L、0.1 mol/L。
答案:A
3.下列液体pH>7的是( )
A.人体血液 B.蔗糖溶液
C.橙汁 D.胃液
解析:人体血液的正常pH范围是7.35~7.45。
答案:A
4.(2011•广州模拟)常温下,0.1 mol/L的一元弱酸溶液的pH为( )
A.1 B.大于1
C.小于1 D.无法确定
解析:假设为一元强酸,则pH=1,据题意为一元弱酸,由于不能完全电离,故c(H+)<0.1 mol/L,pH>1。
答案:B
5.有人建议用AG表示溶液的酸度,AG的定义为AG=lg[c(H+)/c(OH-)],下列表述正确的是( )
A.在25℃时,若溶液呈中性,则pH=7,AG=1
B.在25℃时,若溶液呈酸性,则pH<7,AG<0
C.在25℃时,若溶液呈碱性,则pH>7,AG>0
D.在25℃时,溶液的pH与AG的换算公式为:AG=2(7-pH)
解析:根据定义式可看出:中性溶液中c(H+)=c(OH-),AG=0;酸性溶液,AG>0;碱性溶液,AG<0,前三项均错。
AG=lgcH+cOH-=lgc2H+10-14=lgc2(H+)+14=2lgc(H+)+14=2(7-pH)。
答案:D
6.将pH=8的NaOH与pH=10的NaOH溶液等体积混合后,溶液后c(H+)最接近于( )
A.(10-8+10-10) mol/L
B.(10-4+10-6) mol/L
C.(10-8+10-10) mol/L
D.2×10-10 mol/L
解析:混合溶液中c(OH-)=10-1410-8+10-1410-102≈10-42 mol/L,c(H+)=10-1410-42=2×10-10 mol/L。
答案:D
7.常温下,某溶液中由水电离产生的c(H+)=1×10-11 mol/L,则该溶液的pH可能是( )
A.3 B.7 C.8 D.11
解析:根据水的电离平衡H2OH++OH-知:由水电离产生的c(H+)=c(OH-)=1×10-11 mol/L,抑制水电离的原因是溶液中c(H+)或c(OH-)增大,若由于c(H+)增大,则该溶液中c(H+)=1×10-141×10-11=1×10-3 mol/L,即pH=3;若由于c(OH-)增大,则该溶液中c(OH-)=1×10-141×10-11=1×10-3 mol/L,即pH=11。
答案:AD
8.如图所示,能表示人体大量喝水时,胃液的pH变化的图像是( )
A. B. C. D.
解析:由于胃液中有HCl,所以胃液应呈酸性,pH<7。大量喝水时,相当于HCl无限稀释,则开始稀释时,溶液中c(H+)变化较大,所以pH迅速变大,但随着稀释程度增大程度增大,水的电离则不能被忽略,无论怎么稀释,溶液不可能呈碱性,只是无限制的接近中性,即向pH=7靠拢。
答案:A
9.下列有关pH变化的判断中,正确的是( )
A.酸雨样品放置一段时间后,pH会增大
B.随着温度的升高,纯水的pH增大
C.新制氯水经光照一段时间后,pH减小
D.氢氧化钠溶液久置于空气中,pH增大
解析:A项,酸雨放置一段时间后,弱酸H2SO3会被空气中的氧气氧化成强酸H2SO4,溶液中的c(H+)增大,pH变小;B项,温度升高后,水的电离程度增大,c(H+)增大,pH变小;C项,新制氯水光照一段时间后主要成分变为HCl,c(H+)增大,pH减小;氢氧化钠溶液外置与空气中的CO2反应生成Na2CO3,溶液中c(OH-)减小,pH减小。
答案:C
10.(2011•山东师大附中模拟)室温下,在pH=11的某溶液中,由水电离出的c(OH-)为( )
①1.0×10-7 mol/L ②1.0×10-6 mol/L ③1.0×10-3 mol/L ④1.0×10-11 mol/L
A.③ B.④
C.①③ D.③④
解析:pH=11的溶液可能是碱溶液或盐溶液,若为碱溶液,则抑制水的电离,水电离出的c(OH-)=1.0×10-11 mol/L;若为盐溶液,即该盐水解使溶液pH=11,则由水电离出的c(OH-)=1.0×10-3 mol/L。
答案:D
11.若已知100℃时KW=1×10-12,在该温度下将100 mL 0.001 mol/L的NaOH溶液加水稀释到1 L,则溶液的pH为__________,若加水稀释至1 000 L,则溶液的pH__________。
解析:100℃时,100 mL 0.001 mol/L的NaOH溶液,c(OH-)=10-3 mol/L,稀释至1L后,c(OH-)=10-4mol/L,故c(H+)=1×10-1210-4 mol/L=10-8 mol/L,pH=8,100℃时,中性溶液pH=6,若将NaOH溶液加水稀释至1 000 L,则c(OH-)≈10-6 mol/L。即变为极稀的碱液,其pH≈6,但pH>6。
答案:8 约为6
能力提升
12.水是人类生命活动不可缺少的物质。
(1)下列有关水的说法中错误的是__________。
A.矿泉水是纯净物
B.纯水几乎不导电,所以水是非电解质
C.高效催化剂可使水分解获得氢气,同时释放能量
D.非电解质的水溶液中无离子存在
(2)写出两项能影响水的电离平衡,且使溶液显酸性的措施:
①________________________________,
②________________________________。
(3)室温下平均每n个水分子中只有一个水分子发生电离,则n=__________。
解析:(1)选A、B、C、D。A项矿泉水含Ca2+、Mg2+等多种离子,不是纯净物;B项水是很弱的电解质;C项要使H2O分解制取氢气,只能吸收能量;D项中任何物质的水溶液中都有水电离的H+、OH-存在。
(2)能影响水的电离平衡,且使溶液显酸性的有:①通入与水反应呈酸性的气体,如CO2、SO2、Cl2、NO2等;②如酸;③加酸式盐如NaHSO4等。
(3)取1 L水,则n(H2O)=1 00018 mol,则1n=10-71 00018,故n=5.56×108
答案:(1)A、B、C、D
(2)①通入CO2 ②加入盐酸(其他合理答案亦可)
(3)5.56×108
13.(2011•崇雅中学高二期末)有一学生在实验室测某溶液的pH。实验时,他先用蒸馏水润湿pH试纸,然后用洁净干燥的玻璃棒蘸取试样进行检测。
(1)该学生的操作是__________(填“正确”或“错误”)的。
(2)如不正确请说明理由,同时请分析是否一定有误差?
____________________________________________________________________________________________________________。
(3)若按此法分别测定c(H+)相等的盐酸和醋酸溶液的pH,误差较大的是__________,原因是________________________________ _________________________________________________________。
解析:测溶液pH时,若先将试纸润湿,相当于把待测液稀释了,若溶液不显中性,则一定会产生误差,若用此方法分别测定c(H+)相等的盐酸和醋酸,则盐酸的pH变化大,误差较大。
答案:(1)错误的 (2)若溶液不显中性,则c(H+)或c(OH-)被稀释,测出的值不是原溶液的pH 不一定有误差,当溶液为中性时不产生误差 (3)盐酸 因为盐酸为强电解质,加水稀释后不再电离,而CH3COOH属于弱电解质,其溶液存在电离平衡,稀释后促进了CH3COOH的电离,故盐酸误差大,CH3COOH误差小
14.(2011•宜昌高二检测)常温下,将pH=2的硫酸溶液和pH=11的氢氧化钠溶液相混合。
(1)若要使混合液的pH为7,则硫酸和氢氧化钠溶液的体积比为__________;
(2)若要使混合液的pH为10,则硫酸和氢氧化钠溶液的体积比为__________。
(3)若将pH=2的硫酸溶液稀释108倍,则所得溶液中c(H+)/c(SO2-4)为__________。
解析:pH=2的硫酸溶液中H2SO4的物质的量浓度为0.01 mol/L2,pH=11的氢氧化钠溶液中NaOH的物质的量浓度为0.001 mol/L,两种溶液混合后,
(1)若混合液的pH为7,说明二者恰好反应,
V(H2SO4)•c(H2SO4)•2=V(NaOH)•c(NaOH),V(H2SO4)∶V(NaOH)=1∶10;
(2)若要使混合液的pH为10,则溶液中c(OH-)=0.000 1 mol/L,则有[V(NaOH)•c(NaOH)-V(H2SO4)•c(H2SO4)•2]÷[V(NaOH)+V(H2SO4)]=0.000 1 mol/L,V(H2SO4)∶V(NaOH)=9∶101;
(3)若使pH=2的硫酸溶液稀释108倍,c(H+)=1×10-7,c(SO2-4)=12×10-10,则所得溶液中c(H+)/c(SO2-4)为2 000。
答案:(1)1∶10 (2)9∶101 (3)2 000
15.温度t℃时,某NaOH稀溶液中c(H+)=10-a mol/L,c(OH-)=10-b mol/L,已知a+b=12,请回答下列问题:
(1)该温度下水的离子积常数KW=__________。
(2)该NaOH溶液中NaOH的物质的量浓度为________,该NaOH溶液中由水电离出的c(OH-)为__________。
(3)给该NaOH溶液加热,pH__________(填“变大”,“变小”或“不变”)。
(4)该温度下若a=8,要中和该NaOH溶液500 mL,需pH=2的盐酸溶液的体积为__________。
解析:(1)KW=c(H+)•c(OH-)=10-a•10-b=10-(a+b)=10-12
(2)c(NaOH)=c(OH-)=10-b mol/L;该溶液中c(H+)=10-a mol/L,NaOH溶液中H+全是水电离的,c(H+)水电离=c(OH-)水电离=10-a mol/L。
(3)温度升高时,KW变大,而c(H+)=KWcOH-,所以c(H+)变大,pH变小。
(4)a=8时,NaOH溶液中c(H+)=10-8 mol/L,c(OH-)=10-1210-8=10-4 mol/L,设需pH=2即c(H+)=10-2 mol/L的盐酸体积为V,则10-4 mol/L×0.5 L=10-2 mol/L•V,得V=5×10-3 L=5 mL
答案:(1)10-12 (2)10-b mol/L 10-a mol/L (3)变小 (4)5 mL
水的电离和溶液酸碱性知识详解
级别:高级教员
来自:山东省临沂市 一、 水的电离和水的离子积
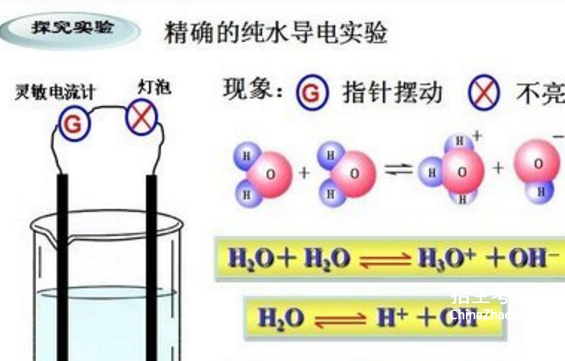
①水是一种极弱的电解质,存在电离平衡: H2O H+ + OH-
影响水的电离平衡的因素可利用化学平衡的相关知识来分析。可用下表练习:
改变的条件
水的电离程度
水电离产生的氢离子浓度 c水(H+)
水电离产生的氢氧根浓度 c水(OH-)
溶液中c(H+)
pH
C(H+)·C(OH-)
(即KW)
通入HCl气体
加入NaOH固体
加 热
加入NaCl固体
加入Na2CO3固体
加入AlCl3固体
②KW = c(H+)·c(OH-), KW指水中的H+离子浓度与OH-离子浓度的乘积,无单位,KW值大小只与温度有关。该等式无论是在纯水中还是在酸、碱、盐等任何的水溶液中恒成立。
在25℃的纯水中, c(H+)=c(OH-)=1×10-7 mol/L,KW=1×10-14(25℃)
③水的电离是吸热反应,温度升高,水的电离平衡向正反应方向移动,水的电离程度增大。所以,温度升高,KW值增大。
要强调以下几点:
①KW = c(H+)·c(OH-)中的c(H+)、c(OH-)指的是水(或水溶液)中的氢离子、氢氧根离子的总浓度,与由水电离出的氢离子、氢氧根离子浓度不同(下文中分别用c水(H+)、c水(OH-) 表示)。
②KW数值的大小只与温度有关,温度一定时,KW为一定值;温度升高,KW值增大。25℃的水(或水溶液)中,KW=1×10-14 。
③任何水溶液中c水(H+)=c水(OH-)恒成立,但c(H+)与c(OH-)往往不相等,导致溶液呈酸性或碱性。
④在纯水中有:c水(H+)=c水(OH-)=c(H+)=c(OH-)
二、 溶液的酸碱性和溶液的pH
在温度一定时c(H+)·c(OH-)是一个常数,但c(H+)与c(OH-)往往不相等。人们规定
c(H+) > c(OH-)时溶液为酸性;c(H+) = c(OH-)时溶液为中性;
c(H+) < c(OH-)时溶液为碱性。
c(H+)与c(OH-)的相对大小是判断溶液酸碱性的根本方法,适用于任何水溶液。
为了方便,化学常采用pH来表示溶液酸碱性的强弱:pH=-lg{c(H+)},一定要注意c(H+)是溶液中的氢离子的总浓度。
温度相同时,pH越小,溶液的酸性越强;pH越大,碱性越强。
在用pH的值或c(H+)、c(OH-)的值来判断溶液酸碱性时,要注意温度的影响,最终要得到c(H+)与c(OH-)的相对大小的关系,才能正确判断。
例1:下列能说明溶液呈酸性的是 ( )
A.c (H+)>1×10-7mol/L B.pH=6
C. c(H+)>c(OH-) D.加入酚酞后溶液不变红
【分析】c(H+)与c(OH-)的相对大小是判断溶液酸碱性的根本方法,故C正确;A、B中的H+浓度都大于1×10-7mol/L,但OH-浓度不一定小于1×10-7mol/L,c(OH-)=KW /c(H+),其大小与KW有关,即与温度有关。温度不同,c(OH-)值不同,可能比c(H+)值大(溶液呈碱性),也可能小(溶液呈酸性),也可能相等(溶液呈中性)。D加入酚酞不变红,只能说明pH小于8,溶液不一定为酸性。
正确答案:B
可以让学生进一步思考:在25℃时,能说明溶液呈酸性的答案又是什么?
三、 有关溶液pH的计算
在求溶液的pH 时,如果涉及到稀释、混合、酸碱反应的情况,一定要先判断溶液的酸碱性。对碱性溶液稀释或混合,或者反应后溶液呈碱性的情况,一定要先求变化后c(OH-),再求c(H+),然后求pH,因为在操作过程中,H+物质的量会发生很大变化,OH-物质的量基本不变,应该以OH-守恒来建立等式关系。(教师可以引导学生进行探究)。思路为:
四、 酸、碱、盐溶液对水的电离平衡的影响
25℃时
c水(H+)=c水(OH-)=1×10-7mol/L,为中性溶液或纯水。
c水(H+)=c水(OH-)<1×10-7mol/L,为酸(或碱)的溶液,水的电离受到抑制。
c水(H+)=c水(OH-)>1×10-7mol/L, 为可水解的盐的溶液,水的电离得到促进,
例2:在25℃时,某溶液由水电离出的H+浓度为1×10-10mol/L,该溶液可能是 ( )
A.NaOH B.NaCl C.HCl D.Na2CO3
【分析】学生往往认为此时溶液呈碱性,错选为A、D答案。依题意只能得到 c水(H+)=c水(OH-)=1×10-10mol/L<1×10-7mol/L,并不能确定溶液是酸性还是碱性,但能肯定的是水的电离受到了抑制,溶质可以是酸,也可以是碱,不可能是能发生水解的盐。
正确答案为:A C
可以将例题中的数据改为“ 1×10-4mol/L”,作为巩固和检测练习。
五、 溶液酸碱性的成因
溶液呈酸性的原因有两种:溶质为酸,酸电离;溶质为强酸弱碱盐,盐水解。
①由于酸(如硫酸、醋酸)的电离,H+主要来自于溶质的电离。
此时,一定要弄清c水(H+)、c水(OH-)、c(H+)、c(OH-)四者之间的关系,尤其是溶液中的氢离子浓度、由水产生的氢离子浓度、由溶质酸电离出的氢离子浓度三个量的意义和关系。
1) c(H+)= c酸(H+)+ c水(H+) (氢离子主要来源为酸的电离)
c(OH-)= c水(OH-)(氢氧根离子完全来源于水的电离)
2)c水(H+)=c水(OH-)<1×10-7mol/L (水的电离受到抑制)
3)c酸(H+)远大于c水(H+),故c酸(H+)≈c(H+),
有 c酸(H+)·c(OH-)=1×10-14
②由于强酸弱碱盐的水解使溶液呈酸性。以NH4Cl溶液为例:
水存在电离平衡H2O H++OH-,NH4Cl电离出的NH4+与OH-结合生成NH3·H2O这种弱电解质,导致水的电离平衡向正反应方向移动,H+浓度增大,溶液呈酸性。此时有:
1)c(H+)=c水(H+) (氢离子完全来源于水的电离)
c(OH-)= c水(OH-)-c反应(OH-)(水电离出的氢氧根部分与NH4+结合了)
2)c水(H+)=c水(OH-)>1×10-7mol/L (水的电离受到促进)
3)c(H+)>c(OH-),溶液呈酸性,但是KW = c(H+)·c(OH-)仍然是一个定值。
同样可以分析,碱性溶液形成的原因及溶液中的氢氧根离子浓度、由水产生的氢氧根离子浓度、由碱电离出的氢氧根离子浓度三个量的关系。
例3:25℃时,
(1)在pH=3的硫酸溶液中,由水电离出的H+的浓度为 ;
(2)在pH=3的溶液中,由水电离出的H+的浓度可能为 。
【分析】(1)(2)共同点是溶液呈酸性,c(H+)=1×10-3mol/L
(1)对pH=3的硫酸溶液,
c(H+)=c酸(H+)+c水(H+)≈c酸(H+)=1×10-3mol/L,
c水(OH-)=c(OH-)=KW /c(H+)=1×10-11mol/L,
而c水(H+)=c水(OH-)=1×10-11mol/L
(2) 对pH=3的溶液,如果溶液呈酸性是因为酸的电离,则分析方法同(1);如果是因为盐类水解而成酸性,则H+都来自于水的电离。
c水(H+)=c(H+)=1×10-3mol/L
正确答案为:(1)1×10-11mol/L (2)1×10-11mol/L或1×10-3mol/L
六、物质的量浓度相同和pH相同的两种溶液(如盐酸和醋酸)
在习题中,经常会遇到同浓度或同pH的两溶液(如盐酸和醋酸)的情况。到底它们什么相同,什么不同呢?
首先注意,HCl强电解质,完全电离,c(H+)=c(HCl);醋酸为弱电解质,部分电离,CH3COOH溶质部分电离后以离子的形式存在,没有电离的部分以分子的形式存在,所以有c(H+)<c(CH3COOH)(后者指溶质浓度)。
溶质浓度与氢离子浓度的关系
盐酸
c(HCl)=c(H+)
醋酸
c(CH3COOH)>c’(H+)
(1)浓度相同的盐酸、醋酸溶液(溶质的浓度相同)
c(HCl)=c(CH3COOH),所以c(H+)>c’(H+),即盐酸中的氢离子浓度大于醋酸溶液中的氢离子浓度。
(2)pH相同的盐酸、醋酸溶液(溶液中的氢离子浓度相同)
c(H+)=c‘(H+),但是c(HCl)<c(CH3COOH),即盐酸的浓度小于醋酸的浓度。
例4:体积相等、pH值都为3的醋酸溶液和盐酸溶液,在相同条件下分别与相同质量的锌粉反应,下列情况不可能存在的是 ( )
A.开始时,两者产生氢气的速率相同
B.如果锌粉都完反应了,则与盐酸反应的锌粉首先反应完
C.有可能盐酸反应完,而醋酸仍有剩余
D.如果锌粉都完全反应了,则两者产生的氢气一样多。
【分析】由题意知pH相同的盐酸、醋酸溶液,溶液中的氢离子浓度相同,盐酸的浓度小于醋酸的浓度。酸与金属反应的速率取决于H+的浓度;产生氢气的量取决于酸的物质的量(在金属过量时)或取决于金属的物质的量(金属反应完,酸过量)。再考虑到醋酸为弱酸,存在电力平衡,不难得到A、C、D可能, B不可能。
正确选项为:B
水的电离和溶液的酸碱性相关热词搜索:酸碱性 溶液
1、浙教版初三科学第一章,物质的酸碱性课件(共3篇)浙教版科学九年级上物质的酸碱性浙教版科学 物质的酸碱性一、酸性物质和碱性物质说一说:生活中有哪些东西是酸性和碱性的?胃酸、醋、葡萄、酸梅、桔子等。酸性物质和碱性物质讲到酸性的物质,你可能会立即想到日常生活中所用的食醋。食醋是一种酸溶液,它有酸味,具有酸性。盐酸、硫酸和硝酸等都是酸。还有橘子汁、番茄酱浙教版初三科学第一章,物质的酸碱性课件。(2016-07-12)
2、科学九年级上册第一章第二节物质的酸碱性课件(共4篇)科学九年级上册第一章第二节第二节 物质的酸碱性1 下列四种物质不属于酸的是( )A HCl B H2SO4 C NaHSO4 D HNO32 醋酸、柠檬酸都是食品加工中常用的酸,他们在水中都能电离生成( )2 A H B OH科学九年级上册第一章第二节物质的酸碱性课件。(2016-07-30)
3、8 1溶液的酸碱性教学设计(共5篇)8.1溶液的酸碱性教学设计。(2016-09-23)
4、实验活动7,溶液酸碱性的检验(共5篇)实验活动7,溶液酸碱性的检验。(2016-09-27)
最新推荐成考报名
更多- 歇后语_歇后语大全_歇后语大全及答案_爆笑歇后语
- 大学排名_大学排名2018排行_大学查询_中国大学名单
- 成语大全_四字成语_在线成语词典_成语查询
- 成语接龙大全查询,成语接龙游戏,在线成语接龙
- 全国安全教育平台入口_学校安全教育平台
- 社保查询网-社会保障卡查询,社会保险查询,社保网上查询
- 汉字简体繁体转换_在线繁体字转换工具
- 数字大写转换|人民币金额(数字)大小写转换在线工具
- 年龄计算器实际岁数计算器 - 周岁虚岁计算器
- 产假计算器-算产假计算器在线2018-2018年产假自动计算器
- 预产期计算器-怀孕孕期计算器-怀孕天数计算
- 中国文库网-教育资源网-范文文章
- 邮编区号查询网
- 致富商机网-致富点子_创业项目
- 创业项目网--最热门的投资项目
- 中国邮政邮编查询号码
- 电话区号查询
- 全国车牌号归属地大全
- 在线网速测试|宽带速度测试
- 人民币汇率查询
- ●理财有没有风险 金融互联网理财
- ●qq网名
- ●2016最新伤感说说
- ●谈笑风生造句
- ●读书的名言
- ●资产清查报告
- ●贫困户申请书
- ●财务自查报告
- ●离婚起诉书
- ●赞美老师的演讲稿
- ●车间管理
- ●车辆购置税
- ●跨越百年的美丽读后感
- ●跟女友离别的话
- ●超市管理制度
- ●起诉状范本
- ●赠别诗大全
- ●描写夏天的句子
- ●描写友谊的诗句
- ●迁户口申请书
- ●转正申请表范本
- ●这个杀手不太冷台词
- ●运动会稿子精选
- ●那么那么造句
- ●送给男朋友的情话大全
- ●钳工实训报告
- ●霸气说说大全
- ●骂人不带脏字的
- ●幼儿园见习个人总结
- ●追女孩子的短信

