导读: 2016年江苏小高考化学(共6篇)2016江苏小高考化学试卷答案解析【真题】2016年江苏小高考化学的试题及答案,在中国招生考试网上会在2016年3月20日之后进行发布,请各位老师耐心等待中国招生考试网的发布和整理。2016年江苏小高考化学的具体的考试时间是:10:45-12:00请各位考生注意进行化学科目的重点知识点的复习和整理...
2016年江苏小高考化学(一)
2016江苏小高考化学试卷答案解析【真题】
2016年江苏小高考化学的试题及答案,在中国招生考试网上会在2016年3月20日之后进行发布,请各位老师耐心等待中国招生考试网的发布和整理。2016年江苏小高考化学的具体的考试时间是:10:45-12:00
请各位考生注意进行化学科目的重点知识点的复习和整理。
>>>【点击下载】2016江苏小高考生物试卷答案<<<
下面是中国招生考试网整理的2015年的江苏小高考化学的试题及答案,各位考生可以参考一下:



2016年江苏小高考化学(二)
2016江苏小高考化学试卷(图片版)
2016年江苏小高考化学(三)
2016江苏小高考化学冲A必备和选择1200题
2016江苏小高考化学冲A必备和选择1200题
1、化合价(常见元素的化合价):
碱金属元素、Ag、H:+1 F:—1
Ca、Mg、Ba、Zn:+2 Cl:—1,+1,+5,+7 Cu:+1,+2 O:—2
Fe:+2,+3 S:—2,+4,+6 Al:+3 P:—3,+3,+5
Mn:+2,+4,+6,+7 N:—3,+2,+4,+5 2、氧化还原反应
定义:有电子转移(或者化合价升降)的反应 本质:电子转移(包括电子的得失和偏移) 特征:化合价的升降
氧化剂(具有氧化性)——得电子——化合价下降——被还原——还原产物 还原剂(具有还原性)——失电子——化合价上升——被氧化——氧化产物 口诀:得——降——(被)还原——氧化剂 失——升——(被)氧化——还原剂 四种基本反应类型和氧化还原反应关系: 氧化还原反应
分解
复分解
置换
3、金属活动性顺序表
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
还 原 性 逐 渐 减 弱
4、离子反应
定义:有离子参加的反应
电解质:在水溶液中或熔融状态下能导电的化合物
非电解质:在水溶液中和熔融状态下都不能导电的化合物 离子方程式的书写:
第一步:写。写出化学方程式
第二步:拆。易溶于水、易电离的物质拆成离子形式;难溶(如CaCO3、BaCO3、BaSO4、AgCl、
AgBr、AgI、Mg(OH)2、Al(OH)3、Fe(OH)2、Fe(OH)3、Cu(OH)2等),难电离(H2CO3、H2S、CH3COOH、HClO、H2SO3、NH3·H2O、H2O等),气体(CO2、SO2、NH3、Cl2、O2、H2等),氧化物(Na2O、MgO、Al2O3等)不拆
第三步:删。删去前后都有的离子
第四步:查。检查前后原子个数,电荷是否守恒 离子共存问题判断:
和-,Fe和-);
①是否产生沉淀(如:Ba2+SO422+OH
②是否生成弱电解质(如:NH
-) +和OH-,H+和CH
43COO【2016年江苏小高考化学】
③是否生成气体(如:H+和CO
2-,H+和SO2-) 33
④是否发生氧化还原反应(如:H+、NO-和Fe2+/I-,Fe3+和I-)
3
5、放热反应和吸热反应
化学反应一定伴随着能量变化。
放热反应:反应物总能量大于生成物总能量的反应
常见的放热反应:燃烧,酸碱中和,活泼金属与酸发生的置换反应 吸热反应:反应物总能量小于生成物总能量的反应 常见的吸热反应:Ba(OH)2·8H2O和NH4Cl的反应,灼热的碳和二氧化碳的反应 C、CO、H2还原CuO 6、各物理量之间的转化公式和推论
⑴微粒数目和物质的量:n==N / NA,N==nNA NA——阿伏加德罗常数。规定0.012kg12C所含的碳原子数目为一摩尔,约为6.02×1023个,该数目称为阿伏加德罗常数 ⑵物质的量和质量:n==m / M,m==nM ⑶对于气体,有如下重要公式

a、气体摩尔体积和物质的量:n==V / Vm,V==nVm 标准状况下:Vm=22.4L/mol
b、阿伏加德罗定律:同温同压下V(A) / V(B) == n(A) / n(B) == N(A) / N(B) c、气体密度公式:ρ==M / Vm,ρ1/ρ2==M1 / M2 ⑷物质的量浓度与物质的量关系
(对于溶液)a、物质的量浓度与物质的量 C==n / V,n==CV
b、物质的量浓度与质量分数 C==(1000ρω) / M
7、配置一定物质的量浓度的溶液
①计算:固体的质量或稀溶液的体积
②称量:天平称量固体,量筒或滴定管量取液体(准确量取) ③溶解:在烧杯中用玻璃棒搅拌 ④检漏:检验容量瓶是否漏水(两次)
⑤移液:冷却到室温,用玻璃棒将烧杯中的溶液转移至选定容积的容量瓶中 ⑥洗涤:将烧杯、玻璃棒洗涤2—3次,将洗液全部转移至容量瓶中(少量多次)
⑦定容:加水至叶面接近容量瓶刻度线1cm—2cm处时,改用胶头滴管加蒸馏水至溶液的凹液面最低
点刚好与刻度线相切
⑧摇匀:反复上下颠倒,摇匀,使得容量瓶中溶液浓度均匀 ⑨装瓶、贴标签
必须仪器:天平(称固体质量),量筒或滴定管(量液体体积),烧杯,玻璃棒,容量瓶(规格),胶头滴管
9、钠的氧化物比较
11、金属的通性:导电、导热性,具有金属光泽,延展性,一般情况下除Hg外都是固态
12、金属冶炼的一般原理:
①热分解法:适用于不活泼金属,如Hg、Ag
②热还原法:适用于较活泼金属,如Fe、Sn、Pb等
③电解法:适用于活泼金属,如K、Na、Al等(K、Ca、Na、Mg都是电解氯化物,Al是电解Al2O3) 13、铝及其化合物 Ⅰ、铝
①物理性质:银白色,较软的固体,导电、导热,延展性
-②化学性质:Al—3e==Al3+
点燃 点燃 △
a、与非金属:4Al+3O2==2Al2O3,2Al+3S==Al2S3,2Al+3Cl2==2AlCl3 b、与酸:2Al+6HCl==2AlCl3+3H2↑,2Al+3H2SO4==Al2(SO4)3+3H2↑
常温常压下,铝遇浓硫酸或浓硝酸会发生钝化,所以可用铝制容器盛装浓硫酸或浓硝酸
-- c、与强碱:2Al+2NaOH+2H2O==2NaAlO2(偏铝酸钠)+3H2↑ (2Al+2OH+2H2O==2AlO2+3H2↑) 大多数金属不与碱反应,但铝却可以
高温
d、铝热反应:2Al+Fe2O3===2Fe+Al2O3,铝具有较强的还原性,可以还原一些金属氧化物 Ⅱ、铝的化合物
①Al2O3(典型的两性氧化物)
-- a、与酸:Al2O3+6H+==2Al3++3H2O b、与碱:Al2O3+2OH==2AlO2+H2O
②Al(OH)3(典型的两性氢氧化物):白色不溶于水的胶状物质,具有吸附作用 a、实验室制备:AlCl3+3NH3·H2O==Al(OH)3↓+3NH4Cl,Al3++3NH3·H2O==Al(OH)3↓+3NH4+ b、与酸、碱反应:与酸 Al(OH)3+3H+==Al3++3H2O
-- 与碱 Al(OH)3+OH==AlO2+2H2O ③KAl(SO4)2(硫酸铝钾) KAl(SO4)2·12H2O,十二水和硫酸铝钾,俗名:明矾
- KAl(SO4)2==K++Al3++2SO42,Al3+会水解:Al3++3H2O Al(OH)3+3H+ 因为Al(OH)3具有很强的吸附型,所以明矾可以做净水剂 14、铁
①物理性质:银白色光泽,密度大,熔沸点高,延展性,导电导热性较好,能被磁铁吸引。铁在地壳中的含量仅次于氧、硅、铝,排第四。 ②化学性质:
点燃 点燃 △
a、与非金属:Fe+S==FeS,3Fe+2O2===Fe3O4,2Fe+3Cl2===2FeCl3
△
b、与水:3Fe+4H2O(g)===Fe3O4+4H2
c、与酸(非氧化性酸):Fe+2H+==Fe2++H2↑
与氧化性酸,如硝酸、浓硫酸,会被氧化成三价铁 d、与盐:如CuCl2、CuSO4等,Fe+Cu2+==Fe2++Cu Fe2+和Fe3+离子的检验: ①溶液是浅绿色的
Fe2+ ②与KSCN溶液作用不显红色,再滴氯水则变红
③加NaOH溶液现象:白色灰绿色红褐色 ①与无色KSCN溶液作用显红色
Fe ②溶液显黄色或棕黄色
③加入NaOH溶液产生红褐色沉淀 15、硅及其化合物 Ⅰ、硅
硅是一种亲氧元素,自然界中总是与氧结合,以熔点很高的氧化物及硅酸盐的形式存在。硅有晶体
和无定型两种。晶体硅是带有金属光泽的灰黑色固体,熔点高、硬度大、有脆性,常温下不活泼。晶体硅的导电性介于导体和绝缘体之间,是良好的半导体材料,可制成光电池等能源。 Ⅱ、硅的化合物 ①二氧化硅
a、物理性质:二氧化硅具有晶体和无定形两种。熔点高,硬度大。 b、化学性质:酸性氧化物,是H2SiO3的酸酐,但不溶于水
高温
SiO2+CaO===CaSiO3,SiO2+2NaOH==Na2SiO3+H2O,SiO2+4HF==SiF4↑+2H2O
c、用途:是制造光导纤维德主要原料;石英制作石英玻璃、石英电子表、石英钟等;水晶常用来
制造电子工业的重要部件、光学仪器、工艺品等;石英砂常用作制玻璃和建筑材料。
②硅酸钠:硅酸钠固体俗称泡花碱,水溶液俗称水玻璃,是无色粘稠的液体,常作粘合剂、防腐剂、
耐火材料。放置在空气中会变质:Na2SiO3+CO2+H2O==H2SiO3↓+Na2CO3。实验室可以用可溶性硅酸盐与盐酸反应制备硅酸:Na2SiO3+2HCl==2NaCl+H2SiO3↓
③硅酸盐:
a、是构成地壳岩石的主要成分,种类多,结构复杂,常用氧化物的形式来表示组成。其表示方式 活泼金属氧化物·较活泼金属氧化物·二氧化硅·水。如:滑石Mg3(Si4O10)(OH)2可表示为3MgO·4SiO2·H2O
b、硅酸盐工业简介:以含硅物质为原料,经加工制得硅酸盐产品的工业成硅酸盐工业,主要包括
陶瓷工业、水泥工业和玻璃工业,其反应包含复杂的物理变化和化学变化。
水泥的原料是黏土和石灰石;玻璃的原料是纯碱、石灰石和石英,成份是Na2SiO3·CaSiO3·4SiO2;
陶瓷的原料是黏土。注意:三大传统硅酸盐产品的制备原料中,只有陶瓷没有用到石灰石。
16、氯及其化合物
①物理性质:通常是黄绿色、密度比空气大、有刺激性气味气体,能溶于水,有毒。
②化学性质:氯原子易得电子,使活泼的非金属元素。氯气与金属、非金属等发生氧化还原反应,一
般作氧化剂。与水、碱溶液则发生自身氧化还原反应,既作氧化剂又作还原剂。
拓展1、氯水:氯水为黄绿色,所含Cl2有少量与水反应(Cl2+H2O==HCl+HClO),大部分仍以分子形
---式存在,其主要溶质是Cl2。新制氯水含Cl2、H2O、HClO、H+、Cl、ClO、OH等微粒
拓展2、次氯酸:次氯酸(HClO)是比H2CO3还弱的酸,溶液中主要以HClO分子形式存在。是一种具
有强氧化性(能杀菌、消毒、漂白)的易分解(分解变成HCl和O2)的弱酸。
拓展3、漂白粉:次氯酸盐比次氯酸稳定,容易保存,工业上以Cl2和石灰乳为原料制取漂白粉,其
主要成分是CaCl2和Ca(ClO)2,有效成分是Ca(ClO)2,须和酸(或空气中CO2)作用产生次氯酸,才能发挥漂白作用。
18、二氧化硫
①物理性质:无色,刺激性气味,气体,有毒,易液化,易溶于水(1:40),密度比空气大
②化学性质:
a、酸性氧化物:可与水反应生成相应的酸——亚硫酸(中强酸):SO2+H2O H2SO3
可与碱反应生成盐和水:SO2+2NaOH==Na2SO3+H2O,SO2+Na2SO3+H2O==2NaHSO3
b、具有漂白性:可使品红溶液褪色,但是是一种暂时性的漂白 c、具有还原性:SO2+Cl2+2H2O==H2SO4+2HCl 18、硫酸
①物理性质:无色、油状液体,沸点高,密度大,能与水以任意比互溶,溶解时放出大量的热
②化学性质:酸酐是SO
,其在标准状况下是固态 浓硫酸的三大特性
a、吸水性:将物质中含有的水分子夺去(可用作气体的干燥剂) b、脱水性:将别的物质中的H、O按原子个数比2:1脱出生成水 c、强氧化性:
ⅰ、冷的浓硫酸使Fe、Al等金属表面生成一层致密的氧化物薄膜而钝化
△ ⅱ、活泼性在H以后的金属也能与之反应(Pt、Au除外):Cu+2H2SO4(浓)===CuSO4+SO2↑+2H2O【2016年江苏小高考化学】
△ ⅲ、与非金属反应:C+2H2SO4(浓硫酸)===CO2↑+2SO2↑+2H2O
ⅳ、与较活泼金属反应,但不产生H2
d、不挥发性:浓硫酸不挥发,可制备挥发性酸,如HCl:NaCl+H2SO4(浓)==NaHSO4+HCl 三大强酸中,盐酸和硝酸是挥发性酸,硫酸是不挥发性酸
2016年江苏小高考化学(四)
2016年江苏化学高考(含答案)
绝密★启封并使用完毕前
试题类型:
化学
注意事项:
考生在答题前请认真阅读本注意事项及各题答案要求
1.本试卷共10页,包含选择题(第1题~第15题,共15题)和非选择题(第16题~第21题,共6题)两部分。本卷满分为120分,考试时间为100分钟。考试结束后,请将本卷和答题卡一并交回。 2.答题前,考生务必将自己的姓名、准考证号用0.5毫米黑色水笔填写在试卷和答题卡规定位置。 3.请认真核对监考员在答题卡上所粘贴的条形码上的姓名、准考证号和本人是否相符。
4.作答选择题,必须用2B铅笔将答题卡上对应选项的方框涂满、涂黑;如需改动,请用橡皮擦干净后,再涂选其他答案。做大非选择题,必须用0.5毫米黑色的签字笔在答题卡上的指定位置做大,在其他位置作答一律无效。
5.如需作图,需用2B铅笔绘、写清楚,线条、符号等需加黑、加粗。
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 Mg 24 Al 27 S 32 Cl 35.5 K 39 Ca 40 Mn 55 Fe 56 I 127
第Ⅰ卷
一、单项选择题:本题共10小题,每小题2分,共计20分,每小题只有一个选项符合题意。 .............
1.大气中CO2含量的增加会加剧“温室效应”。下列活动会导致大气中CO2含量增加的是
A.燃烧煤炭供热 B.利用风力发电 C.增加植被面积 D.节约用电用水 2. 下列有关化学用语表示正确的是
A.中子数位10的氧原子:188O C.硫化钠的电子式:
B.Mg2+的结构示意图:
D.甲酸甲酯的结构简式:C2H4O2
3.下列有关物质的性质与用途具有对应关系的是 A.SO2具有氧化性,可用于漂白纸浆 B.NH4HCO3受热易分解,可用作氮肥 C.Fe2(SO4)3易溶于水,可用作净水剂 D.Al2O3熔点高,可用作耐高温材料
4.短周期主族元素X、Y、Z、W原子序数依次增大,X原子的最外层有6个电子,Y是迄今发现的非金属性最强的元素,在周期表中Z位于IA族,W与X属于同一主族。下列说法正确的是 A.元素X、W的简单阴离子具有相同的电子层结构 B.由Y、Z两种元素组成的化合物是离子化合物 C.W的简单气态氢化物的热稳定性比Y的强 D.原子半径:r(X)<r(Y)<r(Z)<r(W) 5.下列指定反应的离子方程式正确的是
A.将铜插入稀硝酸中:Cu+4H++2NO3 -
Cu2++2NO2↑+H2O
2 Fe3+
Al(OH)3↓+3NH4 H2SiO3↓+3 Na+
+

B.向Fe2(SO4)3溶液中加入过量铁粉:Fe3++Fe
C.向Al2(SO4)3溶液中加入过量氨水:Al3++3NH3﹒H2OD.向Na2SiO3溶液中滴加稀盐酸:Na2SiO3+3H+
6.根据侯氏制碱原理制备少量NaHCO3的实验,经过制取氨气、制取NaHCO3、分离NaHCO3、干燥NaHCO3四个步骤,下列图示装置和原理能达到实验目的的是
7.下列说法正确的是
A.氢氧燃料电池工作时,H2在负极上失去电子 B.0.1molL1Na2CO3溶液加热后,溶液的pH减小 C.常温常压下,22.4L Cl2中含有的分子数为6.021023
个
D.室温下,稀释0.1molL1CH3COOH溶液,溶液的导电能力增强 8.通过以下反应均可获取H2。下列有关说法正确的是 ①太阳光催化分解水制氢:2H2

O(l) 2H2(g)+ O2(g) ΔH1=571.6kJ·mol–1
②焦炭与水反应制氢:C(s)+ H2
O(g)【2016年江苏小高考化学】
CO(g)+ H2(g)ΔH2=131.3kJ·mol–1
③甲烷与水反应制氢:CH4(g)+ H2
O(g) CO(g)+3 H2(g)ΔH3=206.1kJ·mol–1
A. 反应①中电能转化为化学能 B. 反应②为效热反应
C. 反应③使用催化剂,ΔH3减小 D. 反应CH4(g)
C(s)+2 H2(g)的ΔH3=74.8kJ·mol–1
9.在给定的条件下,下列选项所示的物质间转化均能实现的是
A.SiOHCl(aq)H
2SiCl42Si
B. FeSO22SO2H2O
煅烧
H2SO4 C. NH2
HCl(aq)
2高温、高压、催化剂
NH3NH4Cl(aq)
HCl(aq)电解
D. MgCO3MgCl2Mg
10.下列图示与对应的叙述不相符合的是
A. B. C. D.
图甲表示燃料燃烧反映的能量变化
图乙表示酶催化反应的反应速率随反应温度的变化 图丙表示弱电解质在水中建立电离平衡的过程 图丁表示强碱滴定强酸的滴定曲线
二、不定项选择题:本题共5个小题,每小题4分,共计20分,每个小题只有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题得0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且全部选对的得4分,但只要选错一个,该小题就得0分。
11.化合物X是一种医药中间体,其结构简式如图所示。下列有关化合物X的说法正确的是 A.分子中两个苯环一定处于同一平面 B.不能与饱和Na2CO3
C.在酸性条件下水解,水解产物只有一种 D.1 mol化合物X最多能与2 molNaOH反应
12.制备(NH4)2Fe(SO4)2·6H2O的实验中,需对过滤出产品的母液(pH<1)进行处理。常温下,分别取母液并向其中加入指定物质,反应后的溶液中主要存在的一组离子正确的是
2+++-2-A.通入过量Cl2:Fe、H、NH4、Cl、SO4
+2++2--
B.加入过量NaClO溶液:NH4、Fe、H、SO4、ClO
+2++2--C.加入过量NaOH溶液:Na、Fe、NH4、SO4、OH +2----D.加入过量NaClO溶液:Na、SO4、Cl、ClO、OH
2242242424L-1的H2C2O4
和NaOH混合溶液,溶液中部分微粒的物质的量浓度随PH的变化曲线如右图所示。下列指定溶液中微粒的
物质的量浓度关系一定正确的是
A.PH=2.5的溶液中:c(H2C2O4)+ c(C2O42-)> c(HC2O4-) B.c(Na+)=0.100 mol·L-1的溶液中:c(H+)+c(H2C2O4)=c(OH-)+ c(C2O42-) C.c(HC2O4-)= c(C2O42-)的溶液中:c(Na+)>0.100 mol·L-1+ c(HC2O4-) D.PH=7的溶液中:c(Na+)>2 c(C2O42-)
CH3OH(g)15.一定温度下,在3个体积均为1.0 L的容量密闭容器中反应2H( 达到平衡,下+CO(g)2g)列说法正确的是
A .该方应的正反应放热
B.达到平衡时,容器Ⅰ中反应物转化率比容器Ⅱ中的大 C达到平衡时,容器Ⅱ中c(H2)大于容器Ⅲ中c(H2)的两倍 D.达到平衡时,容器Ⅲ中的反应速率比容器Ⅰ中的大
第II卷
非选择题
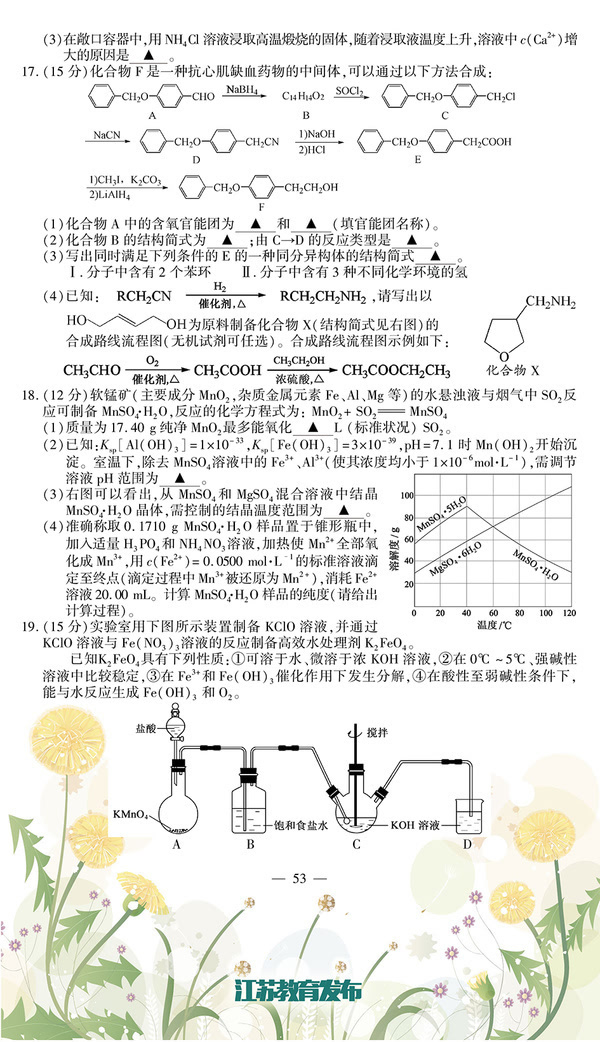
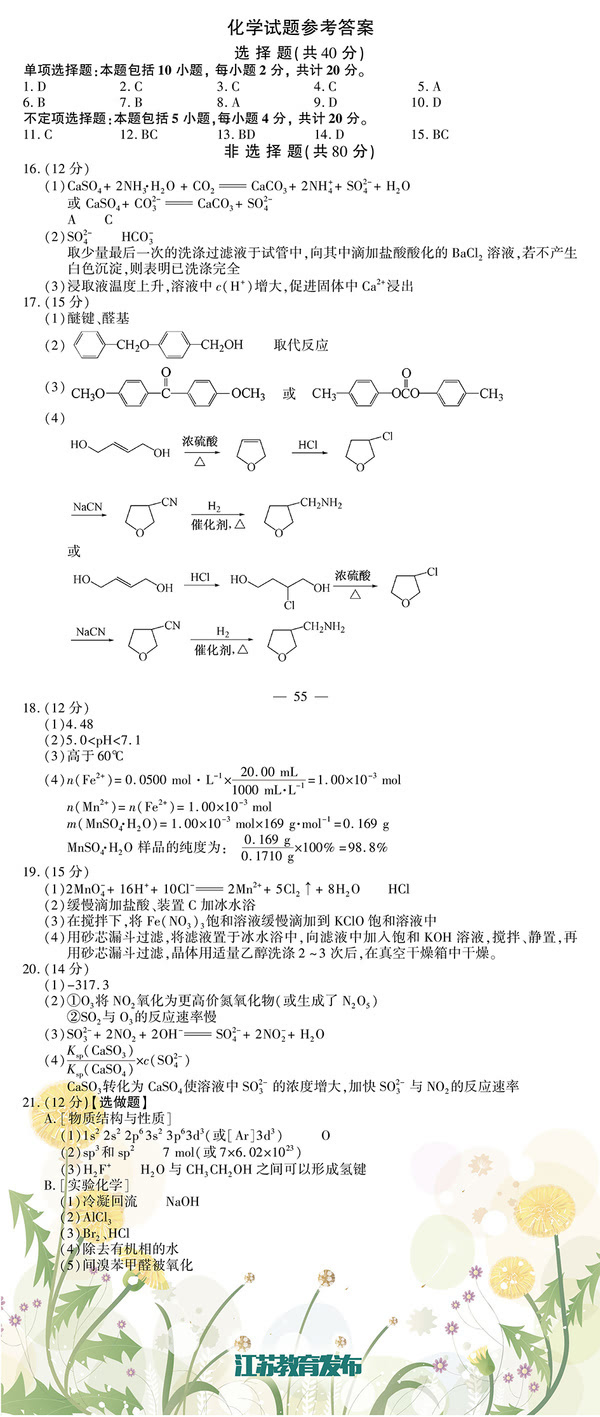
16.(12分)以电石渣[主要成分为Ca(OH)2和CaCO3]为原料制备KCLO3的流程如下:
(1)氯化过程控制电石渣过量,在75℃左右进行。氯化时存在Cl2与Ca(OH)2作用生成Ca(ClO)2的反应,
Ca(ClO)2进一步转化为Ca(ClO3)2,少量Ca(ClO)2 分解为CaCl2和O2。 ①生成Ca(ClO)2的化学方程式为 ▲ 。
②提高Cl2转化为Ca(ClO3)2的转化率的可行措施有 ▲ (填序号)。 A.适当减缓通入Cl2速率 B.充分搅拌浆料 C.加水使Ca(OH)2完全溶解 (2)氯化过程中Cl2 转化为Ca(ClO3)2的总反应方程式为
6 Ca(OH)2+6 Cl2====== Ca(ClO3)2+5 CaCl2+6H2O
氯化完成后过滤。
①渣的主要成分为 ▲ (填化学式)。
②滤液中Ca(ClO3)2与CaCl2的物质的量之比n[Ca(ClO3)2] ∶n[CaCl21∶5(填“>”、“<”或“=”)。 (3)向滤液中加入稍过量KCl固体可将Ca(ClO3)2转化为KClO2,若溶液中KClO3的含量为100g▪L-1,从
该溶液中尽可能多地析出KClO3固体的方法是 ▲ 。
17.(15分)化合物H是合成抗心律失常药物泰达隆的一种中间体,可通过以下方法合成:
(1)D中的含
氧官能团名称为____________(写两种)。
(2)F→G的反应类型为___________。
(3)写出同时满足下列条件的C的一种同分异构体的结构简式_________。
①能发生银镜反应;②能发生水解反应,其水解产物之一能与FeCl3溶液发生显色反应; ③分子中只有4种不同化学环境的氢。
(4)E经还原得到F,E的分子是为C14HO3N,写出E的结构简式___________。
已知:①苯胺()易被氧化
2016年江苏小高考化学(五)
江苏省2016年小高考化学常考必背知识点
高中化学学业水平测试复习纲要——必修1
1. 托盘天平精确到,量筒精确到。 2. 3.
4.
5.分离提纯的装置:
依次为:过滤、 蒸发、 蒸馏、 萃取(分液)。
6. (1)过滤用于分离固体和液体的混合物,主要仪器:漏斗。
(2)蒸发的主要仪器:蒸发皿。当蒸发皿中出现较多的固体时,停止加热。不可加热至蒸干。
(3)蒸馏用于分离液体混合物,(主要仪器包括蒸馏烧瓶,冷凝管)如:乙醇和水的混合物。冷凝水“下进上出”。 (4)萃取可用于提取碘水中的碘单质。主要仪器:分液漏斗;萃取剂不能溶于水,如四氯化碳,不可使用酒精。
(5)分液用于分离互不相溶的液体,如:乙酸乙酯和饱和Na2CO3溶液,植物油和水。主要仪器:分液漏斗。使用时注意“下层放、上层倒”。
-
7.1数值与该物质
的相对分子(原子)量相同(如氯化氢相对分子量为:36.5,摩尔质量为:36.5g/mol) 8. 22.4mol/L的使用条件:
①标准状况下(0℃ 101KPa);②气体。(注:水在标准状况下为液体)
9. 物质的量的计算的四个公式:
10. 溶液稀释的公式:
11. 配制一定物质的量浓度溶液必需的仪器:×× mL容量瓶、烧杯、玻璃棒、胶头滴管。 ..12.
有关物质的量在化学方程式计算中的应用做题步骤:
(1),将已经m,V气,c、V液计算成n,(2)列化学方程式将已知与待求的物质建立联系,求出待出物质的n(3)将求出的n转化为最终要求的m,V气,c、V液 13.
14. Fe(OH)3胶体的制备方法:是FeCl3+3+NaOH;区分胶体与溶液
的方法是:丁达尔效应(用光束照射有光亮的通路)。胶体与其它分散系本质区别是:分散质粒子直径在1~100nm之间而不是丁达尔效应。 15.
-
-
-
电解质。电离方程式:
如H2SO4= 2H++SO42 Ba(OH)2 =Ba2+ +2OH Na2CO3 = 2Na++ CO32 16. 在离子反应中可以拆开的物质:
强酸(HCl、H2SO4、HNO3)、
强碱[KOH、NaOH、Ba(OH)2、Ca(OH)2]、
可溶性盐(钾、钠、铵盐个个拆,硝酸盐类也相同,氯化物仅银(AgCl)不拆,
硫酸盐仅钡(BaSO4)不拆,碳酸盐拆钾钠铵,) 17. 离子方程式典型错误:
1) 电荷、原子不守恒,如:Fe+Fe3+=2Fe2+、Na+H2O=Na++OH-+H2 2) 拆分错误,如:
碳酸钙与稀盐酸反应不能写成:CO32+2H+ = CO2↑+H2O,
-
应写成:CaCO3+2H+ =Ca2++ CO2↑+H2O
3) 化学原理错误,如:Fe和HCl反应不能写成2Fe+6H+=2Fe3++3H2↑,
应写成Fe+2H+=Fe2++H2↑;
18. 不能与H+共存的离子有:OH2
-
-
-
19. 不能与OH++2+2+
-
-
20. 不能与CO32+++-
21. Cl不能与Ag+共存。 SO42不能与Ba2+共存。
-
-
22. 有色离子有:Cu2+(蓝色)、Fe3+(黄色)、Fe2+(浅绿色)、MnO4(紫红色)
-
23. 24.
反应前后元素化合价发生变化的反应是氧化还原反应。一般而言,有单质参与的氧化还原的口决:升 失 氧化(2) 还原剂(性);化合价升高的元素失去电子,
反应一定是氧化还原反应。
含该元素的反应物被氧化,发生了氧化反应,该物质是还原剂,具有还原性。 降 得 还原(2) 氧化剂(性)(与上解释方法相同)。 25. 26.
氧化还原相关分析首先从化合价变化入手。
化合价口诀:钾钠氢银铵正一,钙镁钡锌铜正二,铝铁正三,亚铁二,氢氧硝酸
氯负一,硫酸碳酸氧负二,其他元素需计算。 27. 金 28. 氢 29. 钠是质软、密度小、熔点低,遇盐溶液先和水反应。 30. 过
3233. 除杂Na2CO3(NaHCO3)方法:加热。除杂NaHCO3(Na2CO3)34. 铝 35. 既能与HCl反应又能与NaOH反应的物质有:
36. Al(OH)3的制备:AlCl3溶液中滴加氨水至过量 37. Al(OH)3不能溶于氨水中。 38. 不能一步实现的转化有:
39 40. 除杂Fe2O3(Al2O3)试剂:NaOH溶液 41. Fe2O3 Fe(OH)3 42. FeCl2中滴加NaOH红褐色,因为Fe(OH)2为白色沉淀,在空气中极易被氧化变成灰绿色,最后变为红褐色Fe(OH)3沉淀 43. 除杂FeCl2(FeCl3)方法:加铁粉
44. 除杂FeCl3(FeCl2)方法:通氯气或加氯水 45. 单 46. SiO2是制玻璃的原料,还可制光导纤维。 47. 常 48. 氯 49. Fe在Cl2中燃烧,生成50. H2在Cl2中燃烧,苍白色火焰。 51. 氯 52. 氯 53. 氯 54. 漂55. NO56. NO2红棕色﹑有刺激性气味的气体,易溶于水,有毒,NO2与水反应生成硝酸和NO 57. 二氧化硫:无色、有刺激性气味的气体,易溶于水,有毒 58. SO2可使品红溶液褪色,但加热后红色可以恢复 59. 浓H2SO4和C反应产生的SO2和CO2的鉴别现象:
A检验B除去,C检验不褪色,D变浑浊,说明
有CO2存在。
60. 制取氨气装置图:
选碱石灰。
而
61. NH3为无色﹑有刺激性气味的气体,密度比空气小,易溶于水形成氨水 62. 氨63. 铵64. 浓NH3)会反应。 65. 浓66.,不生成H2 67. 硝68.
常温下,铝或铁遇浓硫酸或浓硝酸发生钝化(化学变化)。 ..
高中化学学业水平测试复习纲要——必修2
1. 元素周期表的横行称为周期,共有18种元素。将前
18号元素填于下表中:
2.元素周期表的纵行称为族,共有ⅤA、ⅥA、ⅦA。
3. 元素非金属性越强,越容易与H2反应生成氢化物,其氢化物越稳定,其最高价含氧酸酸性越强。
4. 5. 6. 短周期元素中,原子半径最大的是 最活泼的金属是Na,最活泼的非金属是F,
最强的碱是NaOH,最强的含氧酸是HF。 7. 除稀有气体外,
8. Si 9. 核素的表达: 符号
,其中:质量数= A、 质子数= Z、 中子数= A-Z、 电子数= Z 原子序数=核电核数=质子数=原子的核外电子数 质量数(A)=质子数(Z)+中子数(N)
2016年江苏小高考化学(六)
2016年江苏高考化学卷(含答案)
2016年江苏小高考化学相关热词搜索:2016年化学高考全国卷 2016年高考化学试题
最新推荐成考报名
更多- 歇后语_歇后语大全_歇后语大全及答案_爆笑歇后语
- 大学排名_大学排名2018排行_大学查询_中国大学名单
- 成语大全_四字成语_在线成语词典_成语查询
- 成语接龙大全查询,成语接龙游戏,在线成语接龙
- 全国安全教育平台入口_学校安全教育平台
- 社保查询网-社会保障卡查询,社会保险查询,社保网上查询
- 汉字简体繁体转换_在线繁体字转换工具
- 数字大写转换|人民币金额(数字)大小写转换在线工具
- 年龄计算器实际岁数计算器 - 周岁虚岁计算器
- 产假计算器-算产假计算器在线2018-2018年产假自动计算器
- 预产期计算器-怀孕孕期计算器-怀孕天数计算
- 中国文库网-教育资源网-范文文章
- 邮编区号查询网
- 致富商机网-致富点子_创业项目
- 创业项目网--最热门的投资项目
- 中国邮政邮编查询号码
- 电话区号查询
- 全国车牌号归属地大全
- 在线网速测试|宽带速度测试
- 人民币汇率查询
- ●理财有没有风险 金融互联网理财
- ●qq网名
- ●2016最新伤感说说
- ●谈笑风生造句
- ●读书的名言
- ●资产清查报告
- ●贫困户申请书
- ●财务自查报告
- ●离婚起诉书
- ●赞美老师的演讲稿
- ●车间管理
- ●车辆购置税
- ●跨越百年的美丽读后感
- ●跟女友离别的话
- ●超市管理制度
- ●起诉状范本
- ●赠别诗大全
- ●描写夏天的句子
- ●描写友谊的诗句
- ●迁户口申请书
- ●转正申请表范本
- ●这个杀手不太冷台词
- ●运动会稿子精选
- ●那么那么造句
- ●送给男朋友的情话大全
- ●钳工实训报告
- ●霸气说说大全
- ●骂人不带脏字的
- ●幼儿园见习个人总结
- ●追女孩子的短信

