导读: 化学2014—2015高二海淀第二学期期末试卷(共4篇)...
以下是中国招生考试网www.chinazhaokao.com为大家整理的《化学2014—2015高二海淀第二学期期末试卷》,希望大家能够喜欢!更多资源请搜索成考报名频道与你分享!
化学2014—2015高二海淀第二学期期末试卷(一)
北京市海淀区2014-2015学年高一下学期期末考试化学试题
海淀区高一年级第二学期期末练习
化 学 2015.07
学校 班级 姓名 成绩
可能用到的相对原子质量:H 1 C 12 O 16 Cl 35.5 Fe 56 Cu 64
一、选择题(每小题只有一个选项符合题意。每小题2分,共40分) 1. 雾霾的化学成分较为复杂,包含有下列物质,其中属于有机物的是
A.臭氧 B.一氧化碳 C.氮氧化物 D.碳氢化合物 2. 氧元素在地壳中的含量最多。下列关于18的说法中,正确的是 8OA.质子数为18 B.中子数为18 C.电子数为18 D.质量数为18 3.下列元素中,原子半径最大的是
A.Na B.K C.S D.Cl 4. 下列物质中,含有离子键的是
A. H2O
AB.HCl C.CH4 D.NaOH
5. 下列粒子的结构示意图中,表示镁原子的是
B C.
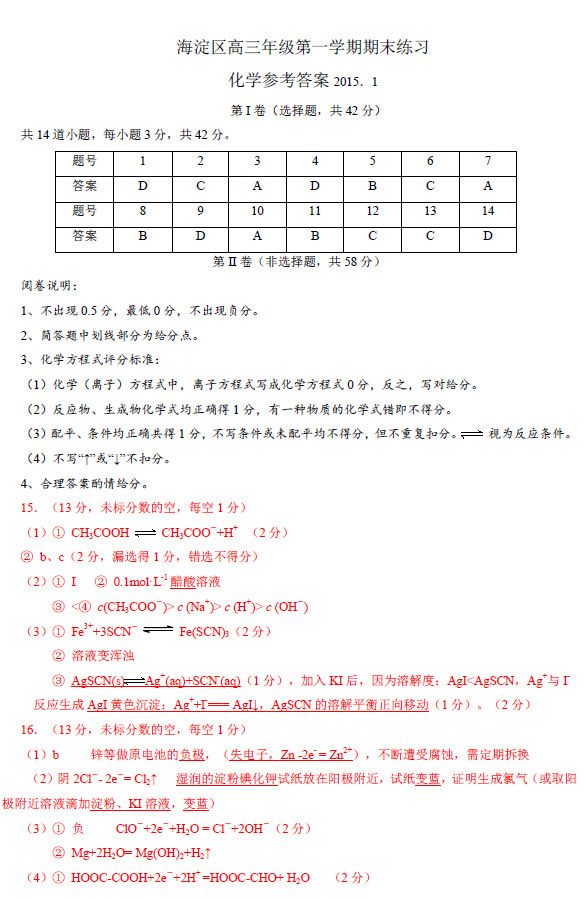
D6.下列说法中,不正确的是 ... A.1和2互为同位素 1H1H
B.淀粉和纤维素互为同分异构体
C. 和 属于同一种物质 D.CH4和C2H6互为同系物
7.下列对应关系不正确的是 ...
8.下列说法中,不正确的是 ...
A.与煤相比,天然气是较清洁的化石燃料
B. 煤的干馏和石油的分馏都是物理变化
C. 煤燃烧产生的硫氧化物和氮氧化物是形成酸雨的主要物质
D. 苯可从煤焦油中提取,它是广泛应用的化工原料,有特殊气味,有毒
9.下列物质中,与 CH 3— CH — CH 3 互为同分异构体的是
A. CH3CH2CH2CH3 B. CH3— CH2 3
CH— CH — 322C. D. CH3 —CH
CH2
3
10.下列反应中,属于取代反应的是
A.乙烯在空气中燃烧 B.乙烯在一定条件下跟HCl反应
C.苯与液溴在FeBr3催化下生成溴苯 D.苯在一定条件下跟H2反应生成环己烷 11.下列有关糖类、油脂、蛋白质的说法中,不正确的是 ...A.淀粉和纤维素都是高分子化合物
B.葡萄糖、油脂和蛋白质都能发生水解反应 C.糖类、油脂、蛋白质均含有C、H、O元素
D.植物油和动物脂肪的主要成分都是高级脂肪酸甘油酯
12.在右图所示的原电池中,下列说法不正确的是 ...
A.该装置能将电能转化为化学能 B.电子由锌片通过导线流向铜片 C.负极反应为 Zn - 2e
-
Zn
2+
D.Cu为正极材料,正极发生还原反应 13.下列关于Na元素的叙述中,不正确的是 ...
A.Na原子最外层有1个电子 B.Na单质能跟水反应放出氢气
C.Na原子比Mg原子更易失去电子 D.Na与氧气在加热条件下生成氧化钠 14.下列排列顺序正确的是 A.原子半径:O>N>C B.热稳定性:H2O>HF>H2S
C.碱性:KOH>NaOH>Mg(OH)2 D.酸性:H3PO4>H2SO4>HClO4
15.用铁片和稀硫酸反应制取氢气时,下列做法能加快化学反应速率的是
A.降低温度 C.用铁粉代替铁片
B.增大铁片的质量
D.用98%的浓硫酸替代稀硫酸
16.下列关于金属冶炼的说法中,不正确的是 ...A. 用热分解法从铁矿石中冶炼金属铁 B. 用电解熔融氯化镁的方法获取金属镁
C. 金属冶炼的过程是将金属从其化合物中还原出来 D. 废旧金属的回收再利用有利于减轻污染、减少能耗 17. 下列说法不正确的是 ...
A.鉴别乙醇、四氯化碳和苯可以用蒸馏水
B.鉴别羊毛织物和棉织物可以用灼烧并闻气味的方法 C.除去乙酸乙酯中含有的乙酸,最好的方法是蒸馏
D.鉴别甲烷、一氧化碳和氢气的方法是:点燃并先后罩上干燥的冷烧杯和涂有澄清石灰水的烧杯
18. 下列叙述中,指定粒子的数目约为6.02×1023的是
A.11.2 L Cl2中含有的氯原子数
B.常温常压下,1.6 g CH4 中含有的质子数
C.标准状况下,22.4 L H2O中含有的氧原子数 D.1 mol Na2SO4溶于水,所得溶液中含有的钠离子数
19.下列实验操作和现象与结论关系不正确
的是
20 .下列实验装置示意图、实验现象及解释均正确的是
21.(14分)元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用。下表是元素周期表的一部分。
请回答下列问题。
(1)非金属性最强的元素名称为___________,它位于元素周期表中的位置是___________。 (2)硅元素的原子结构示意图是 或“碱性”)氧化物。
(3)硼酸(H3BO3)的酸性_________(填“>” 或“<”)碳酸(H2CO3)的酸性,说明你
,其最高价氧化物是 (填“酸性”
判断的理由:______________。 (4)NH3的电子式为
,它属于
(填“离子”或“共价”)化合物。
NH3的还原性_________(填“>” 或“<”)PH3的还原性。
(5)第三周期元素的最高价氧化物对应的水化物中,有一种物质既能与强酸反应又能与强碱反应,写出这种物质跟氢氧化钠溶液反应的化学方程式 。
22.(10分)在已经发现的一百多种元素中,除稀有气体外,非金属元素只有十多种,但与生产生活有密切的联系。
(1)为了提高煤的利用率,常将其气化为可燃性气体,主要反应是碳和水蒸气反应生成水
煤气,化学反应方程式为 ,其中氧化剂是 。
(2)氮是动植物生长不可缺少的元素,合成氨的反应对人类解决粮食问题贡献巨大,反应
N2(g)+3H2(g)
如下:
2NH3(g)
。
① 合成氨的反应中的能量变化如右图所示。该反应是_________
反应 (填“吸热”或“放热”),其原因是反应物化学键断裂吸收的总能量 (填“大于”或“小于”)生成物化学键形成放出的总能量。
②在一定条件下,将一定量的N2和H2的混合气体充入某密闭容器中,一段时间后,下列叙述能说明该反应达到平衡状态的是___________(填序号)。
A.容器中N2 、H2 、NH3共存 B.N2、 NH3浓度相等
C. N2 、H2 、NH3的物质的量之比为1:3:2 D.容器中的压强不随时间变化 (4)工业上用电解饱和食盐水的方法制取氯气、烧碱和氢气。其化学反应方程式为____________。用氯气和烧碱可进一步反应,制得消毒液,反应的离子方程式为
23. (10分)金属铝和铁在生产生活中有着非常广泛的应用。 (1)性质活泼的铝在空气中能稳定存在的原因是 。 (2)写出右图所示铝热反应的化学方程式 。
(3)某研究小组为比较铝和铁的金属性强弱,设计了如下使用注射器的实验。
步骤如下:
I. 取150 mL规格的注射器2个(甲、乙),洗涤干净后,晾干。
II. 分别在甲、乙注射器内放入1.0 g 细的铁丝和 1.0 g薄的铝片(铁丝和铝片均已除去氧化膜),将注射器活塞压至底部,排除空气。
III. 用甲、乙注射器同时吸取30 mL 1.0 mol/L的稀盐酸,之后用胶帽密封。 IV. 观察、记录并比较注射器活塞向外移动的速度,以判断铁、铝的活泼性。
实验结果:铁比铝的反应速率还要快。这显然与理论不符。 ① 结果分析:造成实验结果跟理论不符的主要原因可能是某一实验条件控制有误。请....
你简要指出:____________。 ②
对甲装置的记录显示,从实验开始到2 min末,共收集到H2 67.2 mL(已进行干燥处理并折算为标准状况), 反应前后溶液体积变化忽略不计,该时间段内平均反应速率c(HCl)=
。
③ 对甲和乙实验的记录均显示,开始反应后,产生H2的速率呈现先增大、后减缓的趋
势,下图定性表达了该过程。
则t1~ t2 反应速率增大的主要影响因素是 , t2 ~ t3反应速率逐渐减小的主要影响因素是 。
24.乙烯是重要的有机化工原料,利用乙烯进行下列转化
(1)乙醇分子中官能团的名称为 ,D的结构简式为 。 (2)实验室中用于鉴别乙烯和乙烷的试剂可选用 (填序号)。
A. 水 B. 溴的四氯化碳溶液 C. 氢气 D. 酸性高锰酸钾溶液
化学2014—2015高二海淀第二学期期末试卷(二)
2014-2015年度第二学期期末高二化学试题卷
2014~2015学年度第二学期期末考试
高 二 级化学试题卷
命题人: 审题人:
相对原子质量:H- 1 O- 16 Na- 23 Ag- 108
一、单选题(本题包括20小题,每小题2分,共40分。每小题只有一个....选项符合题意) 1.进行中和滴定实验使用的下列仪器,用蒸馏水洗涤后立即使用,不会引起实验误差 的是
A.酸式滴定管 B.锥形瓶 C.碱式滴定管 D.以上均不正确 2.在某温度时,测得纯水的c (H+)=2.0×10-7mol·L-1,则c(OH-)为 A.2.0×10-7 mol·L-1 B.0.5×10-7 mol·L-1
C.1.01014
2.010
7
mol·L-1 D.c(OH-)无法确定 3.下列化学方程式中,属于水解反应的是 A.H2O + H2O H+3O + OH- B.HCO-3+ OH-
H2O + CO2-3 C.CO2-2 + H2O
H2CO3 D.CO3+ H2O
HCO-3+ OH-
4.同温同浓度的条件下,NaHCO3和NaHSO4溶液中水的电离程度前者与后者之间的关系是 A.大于 B.小于 C.等于 D.不能确定
5.下列溶液一定呈中性的是 A.pH=7的溶液 B.c(H+)=c(OH-)=10-6mol/L的溶液 C.使石蕊试液呈紫色的溶液 D.酸与碱恰好完全反应生成正盐的溶液
6.在一定条件下的反应N2(g)+ 3 H2(g
3(g) △H<0达到平衡,下列变化既
能加快反应速率又能使平衡向正反应方向移动的是
A.升温 B.减压 C.加压 D.加催化剂
7.在一定温度下, 恒容密闭容器中, 充入一定量的NO和O2, 发生反应O2(g)+2NO(g)
2 NO2(g) , 反应已达到平衡的标志是
A.混合气体的颜色不再变化 B.O2 、NO、NO2三种物质的反应速率之比为1∶2 ∶2 C.反应混合物中各组分物质的浓度相等 D.混合气体的密度不再改变
8. 下列说法中错误..的是 A. 放热反应可能开始需要加热才能发生 B. 只有达到活化能的分子才能发生有效碰撞
C. 燃煤火电厂能量转换过程是:化学能→热能→机械能→电能 D. 增加炼铁高炉的高度,可以降低高炉气中CO的含量
9.下列物质的水溶液能导电,且属于强电解质的是( )
A.CH3COOH B.Cl2 C.NH4HCO3 D.SO2
10.下列各组离子在水溶液中能大量共存的是
A.CH3COO-、 Cl- 、K+、 H+ B. SO2-4、Cl-、Ba2+、Na+ C.Cl-、NO-3、NH+4、Na+ D.HCO-3、NO-3、Al3+、K+
11.右图烧杯中均盛装的是海水,
则下列说法正确的是
① ② ③ ④
A.①中的铁受腐蚀最慢 B.④中的铁受腐蚀最快 C.②中C是正极,铁发生析氢腐蚀 D.③中会有红棕色沉淀产生
12.对于0.1 mol·L-1 NH4Cl溶液,下列说法或列式正确的是 A.升高温度,溶液pH升高 B.通入少量HCl,c(NH+4
)和c(Cl-)均增大
C.c(NH+4) + c(OH-)=c(Cl-)+ c(H+) D.c(Cl-) > c(H+) > c(NH+4) > c(OH-)
1
13.下列说法正确的是
A.将水加热,Kw增大,pH不变
B.燃烧热是指可燃物热化学反应方程式中的△H C.用25 mL碱式滴定管量取20.00mL高锰酸钾溶液
D.用惰性电极电解足量的AgNO3溶液时,当有0.2 mole-转移时会析出21.6g银 14.下列热化学方程式书写正确且对应的△H与括号内表述相符..的是 A.2H2 (g) + O2 (g) = 2H2O (l) ΔH = -571.6 kJ/mol(燃烧热) B.NaOH(aq)+ CH3COOH(aq)=CH3COONa(aq)+H2O(l);
△H=-57.3kJ/mol(中和热)
C.H1
2O (g) = H2 (g) + 2
O2 (g) ΔH = -242 kJ/mol (反应热) D.C(s)+ O2 ( g ) = CO2(g) ΔH =-393.5 kJ/mol(反应热) 15. 把 X气体和Y气体混合于2L容器中使它们发生如下反应,
3X(g)+Y(g) nZ(g)+2W(g),5 min末已生成0.2 mol W,若测知以Z浓度变化来表示的反应平
均速率为0.01 mol·L-1·min-
1,则上述反应中Z气体的反应方程式系数n的值是( ) A.1 B.2 C.3 D.4
16.一定量的稀盐酸跟过量锌粉反应时,为了减缓反应速率又不影响生成H2的总量,可采取
的措施是
A.加入少量稀NaOH溶液 B.加入少量CH3COONa固体 C.加入少量NH4HSO4固体 D.加入少量Na2CO3浓溶液 17. 右图为一原电池的结构示意图,下列说法中,错误..
的是 A.Cu电极为正极
B.原电池工作时,电子从Zn电极流出
C.原电池工作时的总反应为:Zn+Cu2+=Zn2++Cu
D.盐桥(琼脂-饱和KCl溶液)中的K+移向ZnSO4溶液
18.室温下,等体积的、pH=2的 HCl和CH3COOH溶液,以下说法正确的是 ( )
A.两溶液中由水电离的c(H+
)前者小于后者
B.两溶液分别和足量的锌反应,生成氢气的体积相等 C.两溶液分别和相同的锌反应,生成氢气的起始速率相等
D.两溶液分别和与其体积相等的、pH=12的NaOH
溶液混合后,都呈中性
19.下面有关电化学的图示,完全正确的是
20.已知:K—10
—16
—13
sp(AgCl)=1.8×10,Ksp(AgI)=1.5×10,Ksp(AgBr)=7.7×10,则下列难溶
盐的饱和溶液中, Ag+浓度大小顺序正确的是 A.AgCl>AgI> AgBr B.AgCl> AgBr>AgI C.AgBr >AgCl>AgI D.AgBr >AgI>AgCl
二、双项选择题(本题包括5小题,每题3分,共15分。每题有2.个.正确选项,未选、错选0分;有2个答案的选1个且正确给2分;全对给3分) 21.已知反应2SO2(g) + O2(g)
2SO3(g) ΔH= -198kJ·mol-1,向某体积恒定的密闭容
器中充入1mol SO2和0.5molO2,在一定条件下发生反应,下图是某物理量(Y)随时间(t)变化的示意图,下列说法正确的是
Y
A.温度T2>T1
B.反应达到平衡后放出99 kJ的热量 C.Y可能是SO2的转化率或SO3的浓度 D.反应达到平衡后容器内气体的密度减小
2
22.下图表示有关反应的反应过程与能量变化的关系,据此判断下列说法中正确的是( )
A.等质量的白磷与红磷充分燃烧,红磷放出的热量多 B.红磷比白磷稳定
C.白磷转化为红磷是放热反应
D.红磷比白磷更容易与氧气反应生成P4O10
23.下列装置或操作能达到目的的是
① ② ③ ④
A.装置①依据两容器内气体颜色变化,判断反应2NO2(g)N2O4(g)平衡移动的方向
B.装置②依据U管两边液面的高低判断Na和水反应的热效应 C.装置③测定中和热
D.装置④依据褪色快慢比较浓度对反应速率的影响
24.25℃时,0.1mol·L-1的某一元碱MOH溶液pH = 13,将它和某一元酸HA的溶液等体积
混合,混合后的溶液恰好为中性。下列判断正确的是( ) A.HA溶液的pH一定为1
B.盐MA可能水解
C.HA物质的量浓度一定为0.1mol·L-1
D.混合后溶液中,c(M+
)一定等于c(A-
) 25. 醋酸溶液中存在电离平衡CH-3COOH
H++CH3COO,下列叙述正确的是
A.0.10mol/L醋酸溶液中粒子浓度的关系满足:
c(CH3COOH)>c(H+)>c(CH3COO-)>c(OH-)
B.CH3COOH溶液中加少量的CH3COONa固体,平衡逆向移动 C.0.10mol/L的CH3COOH溶液中加水稀释,溶液中c(OH-)减小
D.常温下pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合后,溶液pH=7
三、填空题(本题包括2题,共16分)
26.(9分)(1)AgNO3的水溶液呈 (填“酸”、“中”、“碱”)性,实验室在配制AgNO3溶液时, 常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度,以 (填“促进”、“抑制”)其水解。 (2)氯化铝水溶液呈 性 ,原因是(用离子方程式表示): _______________________________; 把AlCl3溶液蒸干,灼烧,最后得到的主要固 体产物是 _______ 。(用化学式表示)
(3)在配制硫化钠溶液时,为了防止发生水解,可以加入少
的 ___________________。
原因是: _______________________________________________ (用离子方程式表示) 。
(4)在25℃下,向浓度均为0.1 mol·L-
1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成 沉
淀(填化学式),生成该沉淀的离子方程式为 。 (已知25℃时Ksp[Mg(OH)2]=1.8×10-11,KsP[Cu(OH)2]=2.2×10-20)
27.(7分)工业上合成合成氨的热化学方程式如下:
N2(g) + 3H2
(g)
2NH3(g) △H = —92.4 kJ/mol
(1)请在答卷上画出以上反应过程中体系的能量变化图(进行必要的标注.......)。 (2)工业上采取以下措施能用勒夏特列原理解释的是( )
A.加入催化剂 B.增大反应容器的压强(50MPa) C.升高反应的温度(5000C) D.设法分离产生的氨气
(3)一定温度下,在密闭容器中进行以上反应。容器中0—4minN2、H2和NH3三种气体的物质的量随时间的变化曲线如图所示。
①若容器为体积为2L的恒容容器,则反应开始2分钟 NH3的平均反应速
率为____ __。
②若容器为体积可变的恒压容器,在4min时往容器中再加入N2和H2各1mol,平衡向移动(填“向右”“、向左”或“不”),平衡常数
填
3
“增大”、“减小”或“不变”);
四、实验题
28.(10分)用中和滴定法测定某烧碱样品的纯度。有以下步骤:
(1) 配制待测液:用已称好的5.0g含有少量杂质(杂质不与盐酸反应)的固体烧碱样品配制 1000mL溶液。除烧杯和玻璃棒外,还需要用到的主要仪器有__________,__________;
(2) 滴定过程:
①盛装0.10 mol/L的盐酸标准液应该使用_______滴定管;
②滴定时双眼应注意观察___________________________________; (3) 误差讨论:(选填“偏高”、“偏低”或“无影响” ) ① 用蒸馏水冲洗锥形瓶,测定结果__________;
② 在滴定过程中不慎将数滴酸液滴在锥形瓶外,测定结果__________; ③ 读数时,滴定前仰视,滴定后俯视,测定结果____________; ④ 装标准液之前,没有用标准液润洗滴定管,测定结果____________;
计算纯度:烧碱样品的纯度是______________(取两次实验所耗盐酸的平均值进行计算,不写计算过程) 五、计算(共2小题)
29.(6分)工业生产SO3的反应为:2SO2(g)+ O2(g)
2SO3(g) ,若在一定温度下,将0.1mol
的SO2(g)和0.06mol O2(g)注入一体积为2L的密闭容器中,10min达到平衡状态,此时测
得容器中有0.08mol的SO3(g)。试求在该温度下:
(1)SO2(g)的平衡转化率。 (2)此反应的平衡常数。 (要求写出计算过程)
30、(13分)超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术将
尾气中的NO和CO转变成CO2和N2,化学方程式如下: 2NO+ 2CO
2CO2+ N2。请回答下列问题:
(1)在上述条件下反应能够自发进行,则反应的H 0(填写“>”、“<”、“=”)。 (2
)该反应的平衡常数表达式为 。
(3)假设在密闭容器中发生上述反应,达到平衡时下列措施能提高NO转化率的是 。
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.缩小容器的体积
(4)研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率。为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。
①请在上表格中填入剩余的实验条件数据。
②请在给出的坐标图中,画出上表中的II、III两个实验条件下混合气体中NO浓度随时间变化的趋势曲线图,并标明各条曲线的实验编号。
4
2014~2015
(4) 。
学年第二学期期末考试
座位号五、计算题 29、(6分) 高
二 级化学答题卷
密
命题人: 审题人:
选择题答案填涂在答题卡上
试 室
封
线
内
考 号不
准
姓 名答
题
三、填空题
26、(9分) 每空1分
(1) , 。
(2),,。 (3) , 。
(4) , 。 27、(7分)
第(1)题图
第(3)②题图
(2) (3)①_____________ ②_____________ _____________
四、实验题 (10分)
1), 。
① ② 。 ①②③④。
5
30、(
13分) (1) (2) (3)
(4)①
②
((2) (3)
化学2014—2015高二海淀第二学期期末试卷(三)
北京市朝阳区2014-2015学年高二下学期期末统考化学试题
北京市朝阳区2014~2015学年度高二年级第二学期期末统一考试
化 学 试 卷 2015.7
(考试时间:90分钟 满分:100分 )
可能用到的相对原子质量:H 1 C 12 O 16 Pb 207
第一部分 (选择题 共42分)
本部分每小题只有一个选项符合题意,每小题2分,共42分 1.下列能源的大量使用会导致全球进一步变暖、雾霾天气增多的是
A.化石能源 B.太阳能 C.氢能 D.地热能 2.下列物质属于弱电解质的是 A.NaCl
B.NaOH
C.CH3COOH D.CO2
3.下列反应中,属于吸热反应的是 A.Al与盐酸反应 B.盐酸和NaOH溶液反应
C.乙醇燃烧反应 D.Ba(OH)2·8H2O晶体与NH4Cl固体反应
4.常温下,最适宜薄荷生长的土壤pH≈8,土壤中的c(OH) 最接近于 A.1×10-5 mol/L B. 1×10-6 mol/L C. 1×10-8 mol/L D. 1×10-9 mol/L 5.下列装置工作时,将化学能转化为电能的是
—
6.下列措施不能加快Zn与1mol/L H2SO4反应产生H2的速率的是 ..A.升高温度 B.用Zn粉代替Zn粒 C.改用0.1mol/L H2SO4与Zn反应 D.滴加少量的CuSO4 溶液 7. 下列物质的溶液在蒸发皿中加热蒸干并灼烧,可以得到该物质的是
A.FeSO4 B.MgSO4 C.AlCl3 D. NH4Cl
8.下列事实中,使用牺牲阳极的阴极保护法进行金属防腐的是 A.地下钢管连接镁块 B.金属护栏表面涂漆
C.汽车底盘喷涂高分子膜 D.水中的钢闸门连接电源的负极 9. 200℃、101kPa时,在密闭容器中充入1molH2和1mol I2,发生反应I2(g) + H2(g)ΔH =-14.9 kJ/mol。反应一段时间后,能说明反应已经达到化学平衡状态的是 A.放出的热量小于14.9 kJ B.反应容器内压强不再变化
C.HI生成的速率与HI分解的速率相等
D.单位时间内消耗a mol H2,同时生成2a mol HI 10.下列解释事实的反应方程式不正确的是 ...
A.碳酸钠溶液显碱性:CO32+H2O错误!未找到引用源。HCO3+ OH
-
-
-
2HI(g)
B.钢铁发生吸氧腐蚀时,铁作负极被氧化:Fe-3e=== Fe3+
-
C.以Na2S为沉淀剂,除去溶液中的Cu2+:Cu2+ + S2 === CuS↓
-
D.向KI溶液中滴加稀硫酸和淀粉溶液,放置在空气中变蓝:4H++4I+O2=== 2I2 + 2H2O【化学2014—2015高二海淀第二学期期末试卷】
-
11.常温下,下列关于NaOH溶液和氨水的说法正确的是 A.相同物质的量浓度的两溶液中的c(OH) 相等 B.pH=13的两溶液稀释100倍,pH都为11
C.两溶液中分别加入少量NH4Cl固体,c(OH) 均减小 D.体积相同、pH相同的两溶液能中和等物质的量的盐酸 12.对可逆反应2SO2(g)+O2
13. 醋酸的电离方程式为CH3
COOH(aq)
H(aq) + CH3COO(aq) ΔH > 0 。 25℃时,
+
-
-
-
3(g) ΔH<0,下列图像正确的是
0.1mol/L醋酸溶液中存在下述关系: ,其中的数值是该温度下醋酸的电离平衡常数(Ka)。下列说法正确的是
A.向该溶液中滴加几滴浓盐酸,平衡逆向移动,c(H) 减小 B.向该溶液中加少量CH3COONa固体,平衡正向移动 C.该温度下0.01mol/L醋酸溶液Ka < 1.75×10-5 D.升高温度,c(H) 增大,Ka变大
+
+
14. 下列关于0.1 mol/L NaHCO3溶液中微粒浓度的关系式正确的是 A.c(CO32) > c(H2CO3)
-
B.c(Na) > c(HCO3) > c(OH) > c(H+)
+
-
-
C.c(Na) = 2[c(H2CO3)+c(HCO3)+c(CO32)]
+
-
-
D.c(Na)+c(H) = c(OH)+c(HCO3)+c(CO32)
+
+
-
-
-
15.下列用来解释实验事实的相关平衡方程式不正确的是
...
16.一定温度下,10 mL 0.4 mol/L H2O2溶液发生催化分解。不同时刻测得生成O2的体积(已
折算为标准状况)如下表:
下列叙述不正确的是(溶液体积变化忽略不计) ...
A.0~6 min 的平均反应速率:v(H2O2) ≈3.3×10-2 mol/(L·min) B.6~10 min 的平均反应速率:v(H2O2) < 3.3×10-2 mol/(L·min) C.反应至6min时,c(H2O2) = 0.20 mol/L D.反应至6min时,H2O2分解了40%
17.下图为H2与 O2反应生成H2O(g)的能量变化示意图:
下列有关叙述不正确的是 ...
A.1 mol H2分子断键需要吸收436 kJ的能量 B.H2(g)+ 1/2O2(g) === H2O(g) ΔH = -241.8 kJ/mol C.反应物的总能量高于生成物的总能量
D.形成化学键释放的总能量比断裂化学键吸收的总能量小【化学2014—2015高二海淀第二学期期末试卷】
18.用石墨作电极,电解盛放在U形管中的饱和NaCl溶液(滴有酚酞溶液),如右图。 下列叙述正确的是 A.通电后,NaCl发生电离
B.通电一段时间后,阳极附近溶液先变红
C.当阳极生成0.1 mol气体时,整个电路中转移了0.1 mol e【化学2014—2015高二海淀第二学期期末试卷】
D.电解饱和食盐水的总反应式为:2NaCl + 2H2O === 2NaOH + H2↑+ Cl2↑
19.实验:① 0.1 mol/L AgNO3溶液和0.1 mol/L NaCl溶液等体积混合得到浊液,过滤。
② 取等量①的滤液于两支试管中,分别滴加等浓度等体积的Na2S溶液、Na2SO4
溶液,前者出现浑浊,后者溶液仍澄清。 ③ 取少量①的沉淀,滴加几滴氨水,沉淀逐渐溶解。
下列分析不正确的是 ...
-
A.①中生成AgCl沉淀,溶液中c(Ag+)和c(Cl)大量减少 B.①的滤液中不含有Ag+
C.②的现象说明该温度下Ag2S比Ag2SO4更难溶
D.③中生成Ag(NH3)2+,使c(Ag+)减小,促进AgCl(s)溶解平衡正向移动 20.已知反应:2NO2(红棕色)
N2O4(无色),分别进行如下两个实验:
实验ⅰ:将NO2球分别浸泡在热水和冰水中,现象如图1。
实验ⅱ:将一定量的NO2充入注射器中后封口,测定改变注射器体积的过程中气体透光率随时间的变化(气体颜色越深,透光率越小),如图2。 ............
下列说法不正确的是 ...
图1
图
2
电解
-
A.图1现象说明该反应为放热反应 B.图2中b点的操作是压缩注射器 C.c点:v (正)>v (逆)
D.若不忽略体系温度变化,且没有能量损失,则T(d)<T(c)
21.热激活电池可用作火箭、导弹的工作电源。一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能。该电池总反应为:PbSO4+2LiCl+Ca === CaCl2+Li2SO4+Pb。下列有关说法不正确的是 ...A.放电时,电子由Ca电极流出 B.放电过程中,Li+向PbSO4电极移动 C.每转移0.2mol电子,理论上生成20.7 g Pb D.负极反应式:PbSO4+2e-+2Li+ === Li2SO4 + Pb
第二部分 (非选择题 共58分)
22.简答题(4分)
(1)通过火法冶金炼出的铜是粗铜,含杂质多,必须进行电解精炼。请在下面方框中画出电解精炼铜的装置。
(2)水解反应在生产生活中有很多应用。有些盐水解程度很大,可以用于无机化合物的制备,如可以用TiCl4与H2O反应,生成TiO2·xH2O,制备时加入大量的水,同时加热。请结合化学用语和必要的文字解释“加热”的作用: 。 23.(8分)应用电化学原理,回答下列问题:
甲
乙
丙
(1)上述三个装置中,负极反应物化学性质上的共同特点是

。
(2)甲中电流计指针偏移时,盐桥(装有含琼胶的KCl饱和溶液)中离子移动的方向是 。
(3)乙中正极反应式为 ;若将H2换成CH4,则负极反应式为 。 (4)丙中铅蓄电池放电一段时间后,进行充电时,要将外接电源的负极与铅蓄电池 极相连接。

(5)应用原电池反应可以探究氧化还原反应进行的方向和程度。按右图连接装置并加入药品(盐桥中的物质不参与反应),进行实验: ⅰ.K闭合时,指针偏移。放置一段时间后,指针偏移减小。 ⅱ.随后向U型管左侧逐渐加入浓Fe2(SO4)3溶液,发现电压表指针的变化依次为:偏移减小→回到零点→逆向偏移。 ① 实验ⅰ中银作 极。
② 综合实验ⅰ、ⅱ的现象,得出Ag+和Fe2+反应的离子方程式是 。
化学2014—2015高二海淀第二学期期末试卷(四)
北京市海淀区2014-2015学年高一下学期期末考试化学试题
海淀区高一年级第二学期期末练习
化 学 2015.07
学校 班级 姓名 成绩
可能用到的相对原子质量:H 1 C 12 O 16 Cl 35.5 Fe 56 Cu 64
一、选择题(每小题只有一个选项符合题意。每小题2分,共40分) 1. 雾霾的化学成分较为复杂,包含有下列物质,其中属于有机物的是
A.臭氧 B.一氧化碳 C.氮氧化物 D.碳氢化合物 2. 氧元素在地壳中的含量最多。下列关于18的说法中,正确的是 8OA.质子数为18 B.中子数为18 C.电子数为18 D.质量数为18 3.下列元素中,原子半径最大的是
A.Na B.K C.S D.Cl 4. 下列物质中,含有离子键的是
A. H2O
AB.HCl C.CH4 D.NaOH
5. 下列粒子的结构示意图中,表示镁原子的是
B C.
D6.下列说法中,不正确的是 ... A.1和2互为同位素 1H1H
B.淀粉和纤维素互为同分异构体
C. 和 属于同一种物质 D.CH4和C2H6互为同系物
7.下列对应关系不正确的是 ...
8.下列说法中,不正确的是 ...
A.与煤相比,天然气是较清洁的化石燃料
B. 煤的干馏和石油的分馏都是物理变化
C. 煤燃烧产生的硫氧化物和氮氧化物是形成酸雨的主要物质
D. 苯可从煤焦油中提取,它是广泛应用的化工原料,有特殊气味,有毒
9.下列物质中,与 CH 3— CH — CH 3 互为同分异构体的是
A. CH3CH2CH2CH3 B. CH3— CH2 3
CH— CH — 322C. D. CH3 —CH
CH2
3
10.下列反应中,属于取代反应的是
A.乙烯在空气中燃烧 B.乙烯在一定条件下跟HCl反应
C.苯与液溴在FeBr3催化下生成溴苯 D.苯在一定条件下跟H2反应生成环己烷 11.下列有关糖类、油脂、蛋白质的说法中,不正确的是 ...A.淀粉和纤维素都是高分子化合物
B.葡萄糖、油脂和蛋白质都能发生水解反应 C.糖类、油脂、蛋白质均含有C、H、O元素
D.植物油和动物脂肪的主要成分都是高级脂肪酸甘油酯
12.在右图所示的原电池中,下列说法不正确的是 ...
A.该装置能将电能转化为化学能 B.电子由锌片通过导线流向铜片 C.负极反应为 Zn - 2e
-
Zn
2+
D.Cu为正极材料,正极发生还原反应 13.下列关于Na元素的叙述中,不正确的是 ...
A.Na原子最外层有1个电子 B.Na单质能跟水反应放出氢气
C.Na原子比Mg原子更易失去电子 D.Na与氧气在加热条件下生成氧化钠 14.下列排列顺序正确的是 A.原子半径:O>N>C B.热稳定性:H2O>HF>H2S
C.碱性:KOH>NaOH>Mg(OH)2 D.酸性:H3PO4>H2SO4>HClO4
15.用铁片和稀硫酸反应制取氢气时,下列做法能加快化学反应速率的是
A.降低温度 C.用铁粉代替铁片
B.增大铁片的质量
D.用98%的浓硫酸替代稀硫酸
16.下列关于金属冶炼的说法中,不正确的是 ...A. 用热分解法从铁矿石中冶炼金属铁 B. 用电解熔融氯化镁的方法获取金属镁
C. 金属冶炼的过程是将金属从其化合物中还原出来 D. 废旧金属的回收再利用有利于减轻污染、减少能耗 17. 下列说法不正确的是 ...
A.鉴别乙醇、四氯化碳和苯可以用蒸馏水
B.鉴别羊毛织物和棉织物可以用灼烧并闻气味的方法 C.除去乙酸乙酯中含有的乙酸,最好的方法是蒸馏
D.鉴别甲烷、一氧化碳和氢气的方法是:点燃并先后罩上干燥的冷烧杯和涂有澄清石灰水的烧杯
18. 下列叙述中,指定粒子的数目约为6.02×1023的是
A.11.2 L Cl2中含有的氯原子数
B.常温常压下,1.6 g CH4 中含有的质子数
C.标准状况下,22.4 L H2O中含有的氧原子数 D.1 mol Na2SO4溶于水,所得溶液中含有的钠离子数
19.下列实验操作和现象与结论关系不正确
的是
20 .下列实验装置示意图、实验现象及解释均正确的是
21.(14分)元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用。下表是元素周期表的一部分。
请回答下列问题。
(1)非金属性最强的元素名称为___________,它位于元素周期表中的位置是___________。 (2)硅元素的原子结构示意图是 或“碱性”)氧化物。
(3)硼酸(H3BO3)的酸性_________(填“>” 或“<”)碳酸(H2CO3)的酸性,说明你
,其最高价氧化物是 (填“酸性”
判断的理由:______________。 (4)NH3的电子式为
,它属于
(填“离子”或“共价”)化合物。
NH3的还原性_________(填“>” 或“<”)PH3的还原性。
(5)第三周期元素的最高价氧化物对应的水化物中,有一种物质既能与强酸反应又能与强碱反应,写出这种物质跟氢氧化钠溶液反应的化学方程式 。
22.(10分)在已经发现的一百多种元素中,除稀有气体外,非金属元素只有十多种,但与生产生活有密切的联系。
(1)为了提高煤的利用率,常将其气化为可燃性气体,主要反应是碳和水蒸气反应生成水
煤气,化学反应方程式为 ,其中氧化剂是 。
(2)氮是动植物生长不可缺少的元素,合成氨的反应对人类解决粮食问题贡献巨大,反应
N2(g)+3H2(g)
如下:
2NH3(g)
。
① 合成氨的反应中的能量变化如右图所示。该反应是_________
反应 (填“吸热”或“放热”),其原因是反应物化学键断裂吸收的总能量 (填“大于”或“小于”)生成物化学键形成放出的总能量。
②在一定条件下,将一定量的N2和H2的混合气体充入某密闭容器中,一段时间后,下列叙述能说明该反应达到平衡状态的是___________(填序号)。
A.容器中N2 、H2 、NH3共存 B.N2、 NH3浓度相等
C. N2 、H2 、NH3的物质的量之比为1:3:2 D.容器中的压强不随时间变化 (4)工业上用电解饱和食盐水的方法制取氯气、烧碱和氢气。其化学反应方程式为____________。用氯气和烧碱可进一步反应,制得消毒液,反应的离子方程式为
23. (10分)金属铝和铁在生产生活中有着非常广泛的应用。 (1)性质活泼的铝在空气中能稳定存在的原因是 。 (2)写出右图所示铝热反应的化学方程式 。
(3)某研究小组为比较铝和铁的金属性强弱,设计了如下使用注射器的实验。
步骤如下:
I. 取150 mL规格的注射器2个(甲、乙),洗涤干净后,晾干。
II. 分别在甲、乙注射器内放入1.0 g 细的铁丝和 1.0 g薄的铝片(铁丝和铝片均已除去氧化膜),将注射器活塞压至底部,排除空气。
III. 用甲、乙注射器同时吸取30 mL 1.0 mol/L的稀盐酸,之后用胶帽密封。 IV. 观察、记录并比较注射器活塞向外移动的速度,以判断铁、铝的活泼性。
实验结果:铁比铝的反应速率还要快。这显然与理论不符。 ① 结果分析:造成实验结果跟理论不符的主要原因可能是某一实验条件控制有误。请....
你简要指出:____________。 ②
对甲装置的记录显示,从实验开始到2 min末,共收集到H2 67.2 mL(已进行干燥处理并折算为标准状况), 反应前后溶液体积变化忽略不计,该时间段内平均反应速率c(HCl)=
。
③ 对甲和乙实验的记录均显示,开始反应后,产生H2的速率呈现先增大、后减缓的趋
势,下图定性表达了该过程。
则t1~ t2 反应速率增大的主要影响因素是 , t2 ~ t3反应速率逐渐减小的主要影响因素是 。
24.乙烯是重要的有机化工原料,利用乙烯进行下列转化
(1)乙醇分子中官能团的名称为 ,D的结构简式为 。 (2)实验室中用于鉴别乙烯和乙烷的试剂可选用 (填序号)。
A. 水 B. 溴的四氯化碳溶液 C. 氢气 D. 酸性高锰酸钾溶液
以上就是中国招生考试网http://www.chinazhaokao.com/带给大家的精彩成考报名资源。想要了解更多《化学2014—2015高二海淀第二学期期末试卷》的朋友可以持续关注中国招生考试网,我们将会为你奉上最全最新鲜的成考报名内容哦! 中国招生考试网,因你而精彩。
最新推荐成考报名
更多- 歇后语_歇后语大全_歇后语大全及答案_爆笑歇后语
- 大学排名_大学排名2018排行_大学查询_中国大学名单
- 成语大全_四字成语_在线成语词典_成语查询
- 成语接龙大全查询,成语接龙游戏,在线成语接龙
- 全国安全教育平台入口_学校安全教育平台
- 社保查询网-社会保障卡查询,社会保险查询,社保网上查询
- 汉字简体繁体转换_在线繁体字转换工具
- 数字大写转换|人民币金额(数字)大小写转换在线工具
- 年龄计算器实际岁数计算器 - 周岁虚岁计算器
- 产假计算器-算产假计算器在线2018-2018年产假自动计算器
- 预产期计算器-怀孕孕期计算器-怀孕天数计算
- 中国文库网-教育资源网-范文文章
- 邮编区号查询网
- 致富商机网-致富点子_创业项目
- 创业项目网--最热门的投资项目
- 中国邮政邮编查询号码
- 电话区号查询
- 全国车牌号归属地大全
- 在线网速测试|宽带速度测试
- 人民币汇率查询
- ●理财有没有风险 金融互联网理财
- ●qq网名
- ●2016最新伤感说说
- ●谈笑风生造句
- ●读书的名言
- ●资产清查报告
- ●贫困户申请书
- ●财务自查报告
- ●离婚起诉书
- ●赞美老师的演讲稿
- ●车间管理
- ●车辆购置税
- ●跨越百年的美丽读后感
- ●跟女友离别的话
- ●超市管理制度
- ●起诉状范本
- ●赠别诗大全
- ●描写夏天的句子
- ●描写友谊的诗句
- ●迁户口申请书
- ●转正申请表范本
- ●这个杀手不太冷台词
- ●运动会稿子精选
- ●那么那么造句
- ●送给男朋友的情话大全
- ●钳工实训报告
- ●霸气说说大全
- ●骂人不带脏字的
- ●幼儿园见习个人总结
- ●追女孩子的短信

